
- •6 Второе начало и необратимость процессов
- •6.4 Эксергия и анергия
- •6.9 Влияние окружающей среды на преобразование энергии
- •6.10 Баланс энтропии для стационарного поточного процесса
- •7 Термодинамические свойства чистых
- •7.1 Термическое уравнение состояния. Р, , t – поверхность
- •7.6 Внутренняя энергия Ван-дер-Ваальсовского газа
- •7.8 Экспериментальные изотермы
- •7.9 Фазовые превращения
- •8 Влажный пар
- •8.3 Изохорный процесс изменения состояния пара
- •9.4 Изобарный процесс изменения состояния водяного пара
- •8.5. Изотермический процесс изменения состояния водяного пара
- •9 Влажный газ
- •9.2 Экстенсивные свойства влажного воздуха
- •9.5 Основные процессы влажного воздуха
- •10. Третье начало термодинамики и элементы статистической термодинамики
- •11 Флуктуации
6 Второе начало и необратимость процессов
ПРЕОБРАЗОВАНИЯ ЭНЕРГИИ
6.1 Необратимость теплообмена
Рис.
6.1 К выводу необратимости теплообмена
 ,
,
 .
Системы гомогенны
.
Системы гомогенны
 ,
,
 ,
но
,
но
 .
Диатермическая перегородка допускает
обмен теплом, но при этом будем считать,
что гомогенность и равновесность каждой
из подсистем остаются неизменными. Это
позволяет предположить, что процессы
изменения внутренней энергии в каждой
из подсистем будут протекать обратимо.
Но в целом в адиабатной системе
.
Диатермическая перегородка допускает
обмен теплом, но при этом будем считать,
что гомогенность и равновесность каждой
из подсистем остаются неизменными. Это
позволяет предположить, что процессы
изменения внутренней энергии в каждой
из подсистем будут протекать обратимо.
Но в целом в адиабатной системе
 процесс теплообмена необратим. Покажем
это.
процесс теплообмена необратим. Покажем
это.
По
отношению к каждой из подсистем такая
необратимость носит внешний характер.
Запишем первое начало термодинамики
для процессов, протекающих в подсистемах
«А»
и
«В»:
 ,
,
 ;
;
 ,
,
 .
Но при этом внутренняя энергия полной
адиабатной системы остается неизменной
.
Но при этом внутренняя энергия полной
адиабатной системы остается неизменной
 ,
,
откуда
следует
 ,
а это возможно, если выполняется
следующее равенство по бесконечно
малым тепловым эффектам
,
а это возможно, если выполняется
следующее равенство по бесконечно
малым тепловым эффектам
 .
(6.1)
.
(6.1)
Найдем соответствующее тепловым эффектам изменение энтропии в каждой из подсистем «А» и «В»
 ;.
;.
 .
.
Тепло и измененные энтропии определяются по обратимым процессам, протекающим в соответствии с принятыми допущениями в каждой из подсистем.
Энтропия системы в целом должна возрасти, так как в ней протекает необратимый процесс. Приращение энтропии системы найдем как сумму
изменения энтропии в подсистемах «А» и «В».
 .
(6.2)
.
(6.2)
 тепло переходит
от В
к А,
следовательно
тепло переходит
от В
к А,
следовательно
 .
.
Приращения
энтропии
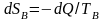 ;
;
 ,
но так как
,
то
,
но так как
,
то
 .
(6.3)
.
(6.3)
Рис.
6.2 Необратимость теплообмена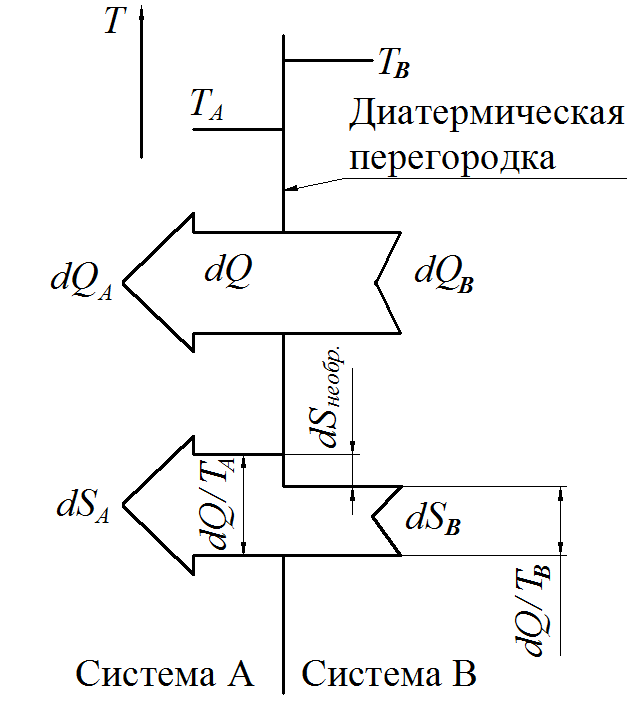
 :
:
 .
(6.4)
.
(6.4)
Иногда для иллюстрации необратимости теплообмена применяют энтропийные диаграммы (рис. 6.2)
Теплообмен связан с переносом энергии. Очевидно, что перенос энергии приводит к переносу энтропии в том же направлении. Можно отметить, что в диатермической перегородке, где проявляется скачок температуры, осуществляется производство энтропии, величина которого может быть рассчитана по выражению
 .
(6.5)
.
(6.5)
Произведенная энтропия увеличивает энтропию, поступающую от системы В, так, что система А воспринимает энтропию величиной
 .
(6.6)
.
(6.6)
Необратимость процесса может оцениваться величиной произведённой энтропии.
Энергию, передаваемую
в форме тепла, за бесконечно малое время
 можно найти из дифференциального
выражения
можно найти из дифференциального
выражения
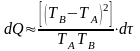 .
(6.7)
.
(6.7)
6.2 Перенос и производство энтропии
Система, воспринимающая или отдающая энергию в форме тепла, соответственно, получает или отдает энтропию величиной
 .
.
Подвод
тепла
 увеличивает, а отвод
увеличивает, а отвод
 уменьшает энтропию системы. Через
границы адиабатной системы тепло и,
следовательно, энтропия не передаются.
При обратимом процессе изменение
энтропии системы совпадает
уменьшает энтропию системы. Через
границы адиабатной системы тепло и,
следовательно, энтропия не передаются.
При обратимом процессе изменение
энтропии системы совпадает

 .
.
Энтропия может не только переноситься через границы системы, но и непосредственно производиться в ней вследствие протекающих необратимых процессов. Это либо диссипативные процессы, либо процессы, связанные с выравниванием параметров состояния по объёму системы. Уменьшение энтропии изолированной адиабатной системы по второму началу невозможно.
В
связи с этим для неадиабатных систем
целесообразно разделение изменения
энтропии
 на две части:
на две части:
 ,
,
 – энтропия, перенесённая с теплом через
границы системы, знак которой определяется;
подводится (+) или отводится (–) тепло.
Что касается энтропии, произведению в
системе, то она определяется неравенством
– энтропия, перенесённая с теплом через
границы системы, знак которой определяется;
подводится (+) или отводится (–) тепло.
Что касается энтропии, произведению в
системе, то она определяется неравенством
 – энтропия,
произведенная в системе.
– энтропия,
произведенная в системе.
Равенство
 возможно
лишь при протекающих полностью обратимо
процессах.
возможно
лишь при протекающих полностью обратимо
процессах.
Тогда для второго начала термодинамики можно дать следующую формулировку:
Изменение энтропии закрытой системы состоит из двух частей – из энтропии, перенесённой с теплом через её границы, и из энтропии, произведенной в системе
 .
.
Произведенная энтропия всегда больше либо равна нулю, то есть она не может быть отрицательной
,
Это означает, что для ограниченных систем уничтожение энтропии невозможно.
В отличие от энтропии системы, перенесённая и произведенная энтропии являются параметрами состояния, а относятся к функциям процесса. Поэтому в уравнении
 (6.8)
(6.8)
энтропию,
произведенную в процессе
 ,
можно рассматривать как количественную
меру его необратимости.
,
можно рассматривать как количественную
меру его необратимости.
6.3 Диссипация энергии
При протекании в системе обратимого процесса энергия, переходящая через границу в форме тепла, равна
 ,
(6.9)
,
(6.9)
а
энергия, передаваемая в форме работы,
– по изменению обобщенных координат
 ,
,

 рассчитывается по очевидной зависимости
рассчитывается по очевидной зависимости
 .
(6.10)
.
(6.10)
Тепло и работа, исходя из объединенного уравнения первого и второго начал термодинамики, соответствуют отдельным слагаемым дифференциала внутренней энергии
 .
(6.11)
.
(6.11)
При необратимых процессах изменение энтропии происходит как вследствие её переноса, так и из-за её производства
 ,
(6.12)
,
(6.12)
где – произведённая энтропия.
Если теплообмен отсутствует между частями системы, то есть внутри системы, то производство энтропии происходит из-за наличия диссипации: трение, тепловыделение в проводнике при прохождении электрического тока, работа вала и так далее.
Рис.
6.3 Адиабатные системы с подводом энергии
в форме работы
и
изменения обобщенных координат
Системы
адиабатны
 .
Обобщенная координата в виде объема в
схемах остается неизменной
.
Обобщенная координата в виде объема в
схемах остается неизменной
 .
Тогда в соответствии с первым началом
термодинамики изменение внутренней
энеогии в них может произойти за счет
механической энергии в первом случае
и за счет выделения Джоулевого тепла
на омическом сопротивлении во втором.
.
Тогда в соответствии с первым началом
термодинамики изменение внутренней
энеогии в них может произойти за счет
механической энергии в первом случае
и за счет выделения Джоулевого тепла
на омическом сопротивлении во втором.
Для
них первое начало может быть записано
в виде
 .
В первой системе обобщенная координата
– объём, во второй – объём и электрический
заряд.
.
В первой системе обобщенная координата
– объём, во второй – объём и электрический
заряд.

где dQэ – элементарное изменение электрического разряда.
Тогда для производства энтропии можно записать

 (6.13)
(6.13)
где dQэ – элементарный электрический заряд системы; dQэт – элементарный электрический заряд, протекающий по резистору с электрическим сопротивлением R.



Они
при производстве работы
 остаются постоянными
,
остаются постоянными
,
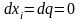 ,
,
где
 –
элементарнее изменение электрического
разряда.
–
элементарнее изменение электрического
разряда.
Энергия, подводимая в форме работы при постоянных или даже отсутствующих обобщенных координата, приводит к увеличению внутренней энергии в процессе производства энтропии.
Необратимый процесс, при котором энергия, подводимая в форме работы, воспринимается системой без изменения обобщенных координат или , называется диссипативным (диссипация работы).
Количественно диссипирующая энергия может быть рассчитана по выражению
 .
.
Тогда для приведенных примеров
 ,
,
то есть подводимая работа полностью диссипирует.
С учетом диссипирующей энергии уравнение для расчета приращения энтропии примет вид
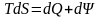 .
(6.14)
.
(6.14)
Для конечного необратимого процесса при квазистатических изменениях состояния системы после интегрирования получим
 .
(6.15)
.
(6.15)
Для
адиабатной системы
,
 и
и
 (6.16)
(6.16)
Таким образом,
площадь под кривой, изображающей в
 – диаграмме реальную адиабату, равна
энергии диссипации
(рис. 6.4). В случае простой системы с
объёмом как единственной обобщённой
координаты можно записать соотношение
– диаграмме реальную адиабату, равна
энергии диссипации
(рис. 6.4). В случае простой системы с
объёмом как единственной обобщённой
координаты можно записать соотношение

Рис.
6.4 Диссипация в необратимом
адиабатном
процессе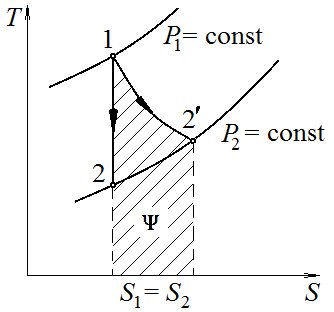
 .
.
Откуда для работы при адиабатно протекающих процессах можно получить

и для работы в целом за процесс изменения от состояния «1» до состояния «2»
 .
(6.17)
.
(6.17)
