
- •1 Термодинамика. Основные понятия
- •1.2 Термодинамическая система и ее состояние
- •1.4 Тепловое равновесие. Нулевое начало термодинамики
- •1.5 Термометр и эмпирическая температура
- •1.6 Термические и калорические параметры состояния
- •1.8 Обратимые и необратимые процессы
- •1.10 Круговой процесс или цикл. Прямой и обратный цикл
- •2 Первое начало термодинамики
- •3 Газовые смеси
- •4 Второй закон термодинамики
- •5 Политропные процессы
3 Газовые смеси
Практически во всех сферах деятельности мы сталкиваемся не с веществами в чистом виде, а с их химическими соединениями, либо с механически перемешенными веществами или растворами. К примеру, рабочие тела почти всех тепловых машин представляют собой некоторую газовую смесь. Не составляет исключение и воздух, которым мы дышим и используем в большинстве случаев как окислитель в камерах сгорания двигателей, топках различных топливосжигающих устройств. Как известно, воздух состоит из 78,08 % азота N2, 20,95 % кислорода О2 и где-то около 1 % составляют примеси других газов. С экологической точки зрения хотелось бы, чтобы процент примесей не возрастал в результате не всегда разумного вмешательства человечества в естественные массообменные процессы природы.
При термодинамических расчетах рабочих процессов тепловых машин мы сталкиваемся с необходимостью определения термодинамических параметров рабочих тел, в подавляющем большинстве случаев представляющих собой газовую смесь продуктов сгорания углеводородных топлив, что требует умения и навыков расчета газовых смесей. Следовательно, должны быть разработаны методы их расчета и способы задания газовых смесей.
3.1 Способы задания газовой смеси
Под смесью идеальных газов понимается механическая смесь химически обособленных исходных газов, подчиняющихся уравнению состояния идеального газа. Тогда будем считать, что и смесь представляет из себя некоторый самостоятельный идеальный газ, термодинамические свойства которого определяются количественным соотношением входящих в него исходных компонентов, то есть свойства газовой смеси однозначно определяются ее составом.
Состав газовой смеси определяется количественным соотношением входящих в него компонентов и может быть задан массовыми, объемными или мольными долями.
Пусть Мсм – масса газовой смеси, а тi – масса i-го компонента, входящего в смесь. Согласно закону сохранения массы будем иметь очевидное равенство:
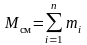 , (3.1)
, (3.1)
где n – число компонентов смеси.
Под массовой долей i-го компонента будем понимать отношение:
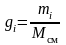 или в процентах
или в процентах
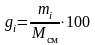 %.
(3.2)
%.
(3.2)
На основании закона сохранения вещества, запишем уравнение баланса массы:
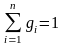 .
(3.3)
.
(3.3)
Если массовые доли заданы в процентах, то
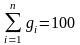 %.
(3.4)
%.
(3.4)
Объемные доли представляют собой отношение парциальных объемов компонентов к объему газовой смеси:
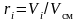 ,
(3.5)
,
(3.5)
где Vi – парциальный объем i-го компонента; Vсм – объем газовой смеси.
Под
парциальным объемом будем понимать тот
объем, которым бы обладал i-й компонент,
находясь при температуре
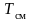 и давлении
и давлении
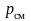 газовой смеси.
газовой смеси.
Нетрудно показать, что парциальные объемы газов прямо пропорциональны их парциальным давлениям. Парциальным называется давление, которое создавал бы i-й газ смеси, если бы он один занимал весь объем смеси, находясь в нем при температуре смеси.
Запишем уравнение Бойля-Мариотта для компонента смеси:
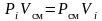 ,
то есть (3.6)
,
то есть (3.6)
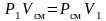 ,
,

или
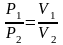 ,
,
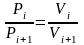 ,
,
где Pi – парциальное давление i-го компонента; Vi – парциальный объем i-го компонента.
Сложим почленно левые и правые части закона Бойля-Мариотта для компонентов:
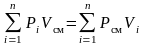 или
или
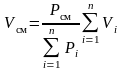 .
.
Согласно закону Дальтона
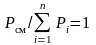 ,
(3.7)
,
(3.7)
тогда 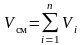 .
(3.8)
.
(3.8)
Объем газовой смеси равен сумме парциальных объемов компонентов, входящих в смесь. Это утверждение равносильно равенству
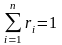 или
или
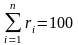 %.
(3.9)
%.
(3.9)
Состав газовой смеси может быть задан и числом молей, входящих в нее компонентов
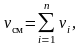 (3.10)
(3.10)
где
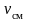 – число молей смеси;
– число молей смеси;
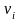 – число
молей i-го
компонента.
– число
молей i-го
компонента.
Тогда под мольной долей будем понимать отношение
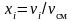 (3.11)
(3.11)
и, согласно закону сохранения количества вещества, будем иметь равенство
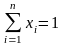 или
или
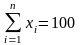 %.
(3.12)
%.
(3.12)
Воспользуемся следствием из закона Авогадро: одинаковые количества различных идеальных газов, находящихся при одинаковых давлениях и температуре, занимают одинаковые объемы.
Запишем 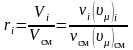 ,
но
,
но
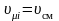 ,
,
тогда
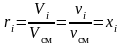 ,
(3.13)
,
(3.13)
то есть объемные и мольные доли компонентов смеси равны между собой.
3.2 Термическое уравнение состояния газовой смеси
Запишем уравнение состояния для i-го компонента газовой смеси, если он занимает весь ее объем и находится там при температуре смеси. Тогда его давление равно парциальному:
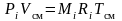 .
(3.14)
.
(3.14)
Просуммируем полученные зависимости для всех компонентов, входящих в смесь
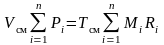 .
.
Вспоминая,
что
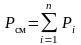 и, вводя обозначение
и, вводя обозначение
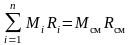 ,
,
получим уравнение состояния газовой смеси:
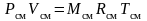 ,
(3.15)
,
(3.15)
где Rсм – газовая постоянная смеси. Ее величина может быть рассчитана из соотношения
.
Поделив его на массу смеси М, получим соотношение:
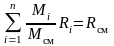 ,
но
,
но
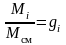 ,
,
тогда
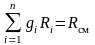 .
(3.16)
.
(3.16)
Введение понятия о кажущейся молекулярной массе смеси упрощает расчеты газовых смесей:
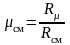 .
(3.17)
.
(3.17)
Или
после подстановки выражения (3.17) для
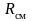 получим с учетом равенства
получим с учетом равенства
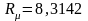 Дж/(моль∙К)
Дж/(моль∙К)
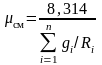 .
(3.18)
.
(3.18)
Запишем уравнение состояния для массы газа mi:
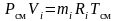 или, с учетом
или, с учетом
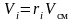 ;
;
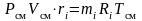 .
.
Последнее выражение преобразуем к виду
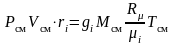 .
.
Если записать выражения для каждого компонента смеси, а затем просуммировать, получим
 ;
,
;
,
тогда 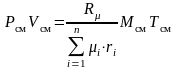 .
.
Таким образом
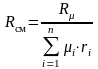 ,
а
,
а
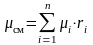 .
(3.19)
.
(3.19)
Получим расчетные
зависимости для
и
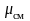 ,
если смесь задана массовыми долями
,
если смесь задана массовыми долями
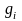 .
Запишем уравнение состояния для М кг
газовой смеси и для
.
Запишем уравнение состояния для М кг
газовой смеси и для
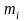 кг
компонентов газов, входящих в смесь,
через их парциальные объемы:
кг
компонентов газов, входящих в смесь,
через их парциальные объемы:
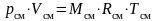 ;
;
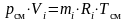 .
.
Если записать второе выражение для каждого компонента, а затем их просуммировать, то получим
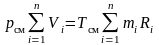 .
.
Перепишем его в
виде
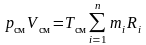 .
.
Поделив последнюю зависимость на уравнение состояния смеси для М кг, получим зависимость для расчета Rсм и см через массовый состав:
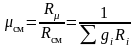 ;
;
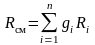 .
(3.20)
.
(3.20)
Последние выражения позволяют по объемным долям и молекулярным массам компонентов рассчитать газовую постоянную смеси и среднюю молекулярную массу.
Зная соотношения между массовыми и объемными долями газов, можно рассчитать парциальные давления
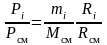 ;
;
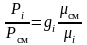 или
или
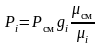 .
(3.21)
.
(3.21)
Запишем закон Бойля-Мариотта для i-го компонента и всей смеси
,
откуда 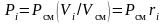 ,
,
тогда 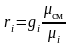 или
или
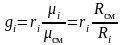 .
(3.22)
.
(3.22)
Приравнивая зависимости (3.21) и (3.22), получим формулы перевода массовых долей в объемные и наоборот:
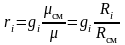 ;
;
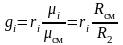 .
(3.23)
.
(3.23)
Плотность газовой смеси:
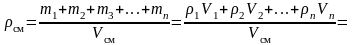
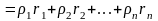 ,
,
таким образом,
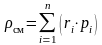 .
(3.24)
.
(3.24)
Выразим
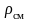 через массовый состав смеси:
через массовый состав смеси:
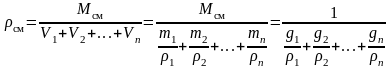 ,
,
следовательно,
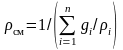 .
.
3.3 Теплоемкость смеси газов
Пусть известны ci – зависимость массовых теплоемкостей компонентов от температуры
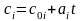 .
.
Для одного килограмма газовой смеси массовая теплоемкость может быть рассчитана по формуле
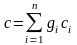 .
(3.25)
.
(3.25)
Или с учетом зависимости теплоемкостей от температуры
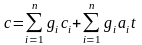 .
.
Если задан объемный состав, то удобней пользоваться объемными теплоемкостями:
для 1 м3
компоненты: 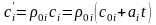 ,
,
для 1 м3
смеси: 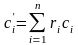 .
(3.26)
.
(3.26)
Или с учетом зависимости от температуры:
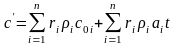 .
(3.27)
.
(3.27)
3.4 Энтропия газовой смеси
Воспользовавшись объединенным выражением первого и второго начал термодинамики, запишем
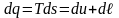
или
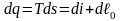 .
.
Распишем выражения, входящие в правые части
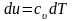 ;
;
 ;
;
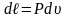 ;
;
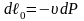 .
.
Тогда после подстановки получим
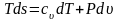 ;
;
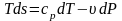 .
.
Предполагая газ совершенным, а следовательно, подчиняющимся уравнению состояния в форме Клапейрона-Менделеева, преобразуем, правые части к виду, удобному для интегрирования (исключим лишнюю переменную)
 ;
;
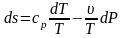 .
.
Запишем уравнение состояния и выразим из него давление и удельный объем
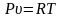 ;
;
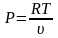 ;
;
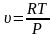 или
или
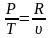 ;
;
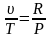 .
.
После подстановки в (3.26) и (3.27)
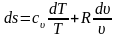 ;
;
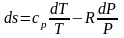 .
.
Проинтегрируем (3.26) и (3.27) от состояния 1 до состояния 2:
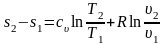 ;
(3.28)
;
(3.28)
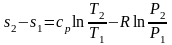 .
(3.29)
.
(3.29)
Если в качестве
независимых переменных будут выбраны
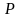 и
,
то выражение для расчета изменения
энтропии в политропных процессах может
быть преобразовано к виду
и
,
то выражение для расчета изменения
энтропии в политропных процессах может
быть преобразовано к виду
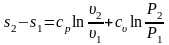 .
(3.30)
.
(3.30)
Известно, что энтропия является аддитивной функцией состояния, а, следовательно, для системы, состоящей из «n» частей, должны вычисляться соотношения
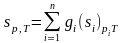 .
(3.31)
.
(3.31)
С другой стороны энтропия может быть рассчитана по зависимости, в которой в явной форме аддитивность не отражена
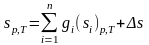 .
(3.32)
.
(3.32)
По своей сути выражения (3.32) и (3.31) эквивалентны.
Энтропия смеси идеальных газов представляет собой сумму энтропий газов, входящих в смесь
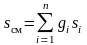 .
(3.33)
.
(3.33)
Для газа с параметрами
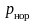 и
и
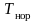 следует, что его энтропия в соответствии
с (3.29) равна
следует, что его энтропия в соответствии
с (3.29) равна
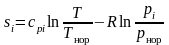 ,
(3.34)
,
(3.34)
где
– температура нормировки;
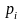 – парциальное давление;
– давление нормировки.
– парциальное давление;
– давление нормировки.
Парциальное давление компонента в смеси можно определить по ранее приведенной зависимости
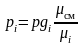 .
.
Тогда второе слагаемое правой части выражения (3.34) может быть сведено к виду
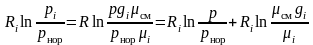 .
.
Следовательно, выражение для энтропии газовой смеси (3.33), представленное в виде аналогичном (1.31), можно переписать
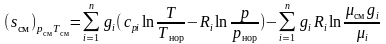 .
(3.35)
.
(3.35)
Выражение, стоящее
в скобках в правой части (3.35), представляет
собой энтропию 1 кг компонента при
параметрах смеси, которую можно
обозначить, как
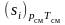 ,
а последнюю сумму можно определить как
приращение энтропии в процессе
необратимого смешения идеальных газов,
входящих в смесь. Так как по смыслу
величина
,
а последнюю сумму можно определить как
приращение энтропии в процессе
необратимого смешения идеальных газов,
входящих в смесь. Так как по смыслу
величина
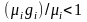 ,
то выражение (1.35) может быть переписано
в виде
,
то выражение (1.35) может быть переписано
в виде
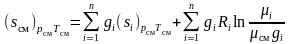 .
(3.36)
.
(3.36)
Учитывая формулу
соотношения массовых и объемных долей
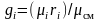 ,
перепишем (3.36)
,
перепишем (3.36)
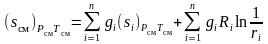 .
(3.37)
.
(3.37)
Из (3.37) следует,
что смешение различных газов при
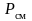 ,
приводит к возрастанию энтропии на
величину энтропии смешения
,
приводит к возрастанию энтропии на
величину энтропии смешения
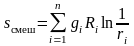 (3.38)
(3.38)
или для отдельно взятого i-го компонента
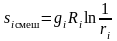 .
(3.39)
.
(3.39)
Выражение (3.32) учитывает возрастание энтропии i-го компонента за счет необратимости процесса смешения.
