
- •Билет 1.
- •1. Теория строения атома.
- •2. Подгруппа кислорода: строение и свойства атомов, простых веществ, химические свойства серы.
- •3. Расставьте коэффициенты в схемах реакций методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления.
- •Билет 2.
- •1. Открытие д.И. Менделеевым Периодического закона.
- •Подгруппа углерода: строение и свойства атомов углерода, простых веществ, образованных углеродом, химические свойства углерода.
- •3. Распознайте с помощью характерных реакций, в какой пробирке находится каждое из предложенных веществ, выданных вам в виде растворов: карбонат натрия, сульфат натрия, хлорид калия.
- •Билет 3.
- •1. Правила определения степеней окисления.
- •2. Подгруппа галогенов: строение и свойства атомов галогенов.
- •3. Получите гидроксид алюминия из сульфата алюминия. Опытным путем докажите его амфотерность.
- •Билет 4.
- •1.Теория окислительно-восстановительных реакций.
- •Билет 5.
- •1. Метод электронного баланса.
- •2. Галогеноводороды и галогеноводородные кислоты.
- •3. По уравнению реакции
- •Билет 6.
- •1. Ионные уравнения реакций.
- •2. Общие физические свойства металлов.
- •3. Дать характеристику одного из элементов - металлов (натрия, кальция, алюминия или железа) (все по выбору).
- •Билет 7.
- •1. Гидролиз солей.
- •3.Дать характеристику одного из элементов - неметаллов (хлора, серы, фосфора, азота, углерода, кремния) (все по выбору).
- •Билет 8.
- •1. Оксиды: их состав, классификация и названия.
- •2. Подгруппа кислорода: строение и свойства атомов, простых веществ, химические свойства серы.
- •3. Испытайте действие раствора нитрата меди (II) на универсальной индикаторной бумажке. Укажите среду раствора. Напишите уравнения реакции гидролиза соли по первой стадии.
- •Билет 9.
- •Типичные реакции кислот
- •Сплавы.
- •3. Дать характеристику одного из элементов - металлов (лития, магния, калия или алюминия) (все по выбору).
- •Билет 10.
- •1. Основания в свете тэд; их классификация и хим. Свойства.
- •2. Положение металлов в пс хим. Элементов д.И. Менделеева, строение их атомов и кристаллов.
- •2. Определите массу оксида углерода(IV) количеством вещества 2ммоль.
- •Билет 11.
- •Генетическая связь между классами неорганических веществ.
- •2. Общие химические свойства металлов. Электрохимический ряд напряжений металлов и взаимодействие металлов с растворами кислот и солей.
- •Билет 12.
- •Билет 13.
- •3. Сколько граммов йода и спирта нужно взять для приготовления 30г 5%-го раствора йодной настойки?
- •Билет 14.
- •1. Составление формул химических веществ по степени окисления.
- •3. Проделайте реакции, подтверждающие качественный состав хлорида бария.
- •Билет 15.
- •1. Оксиды: их состав, классификация и названия.
- •2. Общая характеристика щелочных металлов: строение атомов и свойства простых веществ в сравнении.
- •3. Запишите не менее пяти молекулярных и ионных уравнений возможных реакций получения сульфата железа (II) из соединений различных классов.
- •Билет 16.
- •Понятие о солях. Составление формул солей по степени окисления.
- •1. Свойства алюминия.
- •2. Запишите не менее пяти молекулярных и ионных уравнений возможных реакций получения сульфата бария из соединений различных классов.
- •Билет 17.
- •2. Металлы побочных подгрупп. Особенности строения атомов меди, железа, хрома, марганца.
- •3. В 100 г воды растворили 20 г соли. Рассчитайте массовую долю соли в %.
- •Билет 18.
- •Электрохимический ряд напряжений металлов и взаимодействие металлов с растворами кислот и солей.
- •2. Общие сведения о неметаллах. Понятие аллотропии.
- •2. Какой объем кислорода потребуется для сжигания 120мг магния.
- •Билет 19.
- •1. Подгруппа кислорода
- •2. Заполните пропуски в цепочке превращений и запишите уравнения соответствующих этим превращениям реакций:
- •Билет 20.
- •Генетическая связь между классами неорганических веществ.
- •Подгруппа углерода: кислородные соединения углерода и их свойства.
- •2. Сколько граммов воды и нитрата натрия нужно взять, чтобы приготовить 80г 5%-го раствора?
- •Билет 21.
- •Билет 22.
- •1. Теория строения атома.
- •2. Металлы побочных подгрупп. Особенности строения атомов меди, железа, хрома, марганца.
- •Испытайте действие раствора сульфида натрия на универсальной индикаторной бумажке. Укажите среду раствора. Напишите уравнения реакции гидролиза соли по первой стадии.
- •Периодический закон и периодическая система элементов д.И. Менделеева в свете учения о строении атома.
- •Свойства простого вещества железа.
- •Дать характеристику одного из элементов - неметаллов (хлора, серы, фосфора, азота, углерода, кремния) (все по выбору).
- •Периодическая система элементов д.И. Менделеева в свете учения о строении атома.
- •2. Свойства соединений железа.
- •3.Дать характеристику одного из элементов - металлов (натрия, кальция, алюминия или железа) (все по выбору).
- •1. Химические свойства основных оксидов.
- •2. Подгруппа галогенов: строение и свойства атомов.
- •1. Химические свойства кислотных оксидов.
- •Билет 30.
2. Положение металлов в пс хим. Элементов д.И. Менделеева, строение их атомов и кристаллов.
Если провести диагональ от В к At через элементы главных подгрупп, то по ней и над ней будут располагаться неметаллы, а под ней — металлы. Четные ряды больших периодов состоят только и металлов и все побочные подгруппы ПСХЭ представлены только металлами.
В итоге из 110 элементов ПСХЭ к металлам относятся 88.
Из положения металлов в ПСХЭ можно определить и особенности их строения:
небольшое число (1—3) электронов на внешнем уровне
сравнительно большой радиус атома
Строение кристаллов металлов
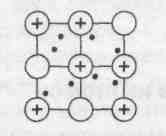
Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают как на рисунке.
В узлах находятся катионы и атомы металлов. Обобществленные электроны (на рисунке они показаны точками) электростатически притягивают катионы металлов, расположенные в узлах кристаллической решетки, обеспечивая ее стабильность и прочность.
2. Определите массу оксида углерода(IV) количеством вещества 2ммоль.
Дано: n(СО2) = 2ммоль |
Решение: m = n × M m(СО2) = n(СО2) × M(СО2) М(СО2)=Mr(СО2)=12+16×2=44мг/ммоль m(СО2) = 2ммоль × 44мг/ммоль = 88мг |
m (СО2) - ? мг |
Ответ: 88 мг оксида углерода(IV).
Билет 11.
Генетическая связь между классами неорганических веществ.
Металл Переходный металл Неметалл
Основный Амфотерный Кислотный
оксид оксид оксид
основание амфотерный гидроксид кислота
соль соль соль
2. Общие химические свойства металлов. Электрохимический ряд напряжений металлов и взаимодействие металлов с растворами кислот и солей.
Металлы – восстановители.
Металлы взаимодействуют с:
неметаллами (Г2,S);
о о +1 -2
2Na + S = Na2 S сульфид натрия
0 0 +2-3
3Mg + N2 = Mg3 N2 нитрид магния
0 0 +3-4
4А1 + ЗС = AL4 С3 карбид алюминия
кислородом (02) – получаются оксиды и пероксиды.
водородом (Н2) - получаются гидриды металлов МН.
водой (Н20);
0 +1 0
2Na + 2НОН = 2NaOH + Н2
железо, взаимодействуют с водой только в раскаленном виде:
3Fe + 4Н20 = Fe304 + 4Н2
растворами кислот (Н+);
По восстановительной способности металлы располагают в ряд, который называют электрохимическим рядом напряжений:
К, Са, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au.
В этот ряд помещен и водород, который, как и металлы, способен отдавать электроны, образуя при этом положительно заряженные ионы Н+.
1. Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из растворов кислот, а стоящие правее, как правило, не вытесняют водород из растворов кислот:
Zn + 2НС1 = ZnCl2 + Н2.
это правило имеет ряд поправок:
а) правило соблюдается, если в реакции металла с кислотой образуется растворимая соль;
б) концентрированная серная кислота и азотная кислота любой концентрации реагирует с металлами по- особому, при этом водород не образуется.
растворами солей (Мп+);
Каждый металл вытесняет из растворов солей другие металлы, находящиеся правее него в ряду напряжений, и сам может быть вытеснен металлами, расположенными левее, например:
Fe + CuS04 = FeS04 + Cu,
Си + HgCl2 = Hg + CuCl2.
оксидами металлов (металлотермия).
3. Расставьте коэффициенты в схемах реакций методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления.
А1+ 02 А1203
HN03+ P H3P04 + N02 + Н20
Ответ см. в лабораторном журнале - практическая работа № 2.
