
- •Билет 1.
- •1. Теория строения атома.
- •2. Подгруппа кислорода: строение и свойства атомов, простых веществ, химические свойства серы.
- •3. Расставьте коэффициенты в схемах реакций методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления.
- •Билет 2.
- •1. Открытие д.И. Менделеевым Периодического закона.
- •Подгруппа углерода: строение и свойства атомов углерода, простых веществ, образованных углеродом, химические свойства углерода.
- •3. Распознайте с помощью характерных реакций, в какой пробирке находится каждое из предложенных веществ, выданных вам в виде растворов: карбонат натрия, сульфат натрия, хлорид калия.
- •Билет 3.
- •1. Правила определения степеней окисления.
- •2. Подгруппа галогенов: строение и свойства атомов галогенов.
- •3. Получите гидроксид алюминия из сульфата алюминия. Опытным путем докажите его амфотерность.
- •Билет 4.
- •1.Теория окислительно-восстановительных реакций.
- •Билет 5.
- •1. Метод электронного баланса.
- •2. Галогеноводороды и галогеноводородные кислоты.
- •3. По уравнению реакции
- •Билет 6.
- •1. Ионные уравнения реакций.
- •2. Общие физические свойства металлов.
- •3. Дать характеристику одного из элементов - металлов (натрия, кальция, алюминия или железа) (все по выбору).
- •Билет 7.
- •1. Гидролиз солей.
- •3.Дать характеристику одного из элементов - неметаллов (хлора, серы, фосфора, азота, углерода, кремния) (все по выбору).
- •Билет 8.
- •1. Оксиды: их состав, классификация и названия.
- •2. Подгруппа кислорода: строение и свойства атомов, простых веществ, химические свойства серы.
- •3. Испытайте действие раствора нитрата меди (II) на универсальной индикаторной бумажке. Укажите среду раствора. Напишите уравнения реакции гидролиза соли по первой стадии.
- •Билет 9.
- •Типичные реакции кислот
- •Сплавы.
- •3. Дать характеристику одного из элементов - металлов (лития, магния, калия или алюминия) (все по выбору).
- •Билет 10.
- •1. Основания в свете тэд; их классификация и хим. Свойства.
- •2. Положение металлов в пс хим. Элементов д.И. Менделеева, строение их атомов и кристаллов.
- •2. Определите массу оксида углерода(IV) количеством вещества 2ммоль.
- •Билет 11.
- •Генетическая связь между классами неорганических веществ.
- •2. Общие химические свойства металлов. Электрохимический ряд напряжений металлов и взаимодействие металлов с растворами кислот и солей.
- •Билет 12.
- •Билет 13.
- •3. Сколько граммов йода и спирта нужно взять для приготовления 30г 5%-го раствора йодной настойки?
- •Билет 14.
- •1. Составление формул химических веществ по степени окисления.
- •3. Проделайте реакции, подтверждающие качественный состав хлорида бария.
- •Билет 15.
- •1. Оксиды: их состав, классификация и названия.
- •2. Общая характеристика щелочных металлов: строение атомов и свойства простых веществ в сравнении.
- •3. Запишите не менее пяти молекулярных и ионных уравнений возможных реакций получения сульфата железа (II) из соединений различных классов.
- •Билет 16.
- •Понятие о солях. Составление формул солей по степени окисления.
- •1. Свойства алюминия.
- •2. Запишите не менее пяти молекулярных и ионных уравнений возможных реакций получения сульфата бария из соединений различных классов.
- •Билет 17.
- •2. Металлы побочных подгрупп. Особенности строения атомов меди, железа, хрома, марганца.
- •3. В 100 г воды растворили 20 г соли. Рассчитайте массовую долю соли в %.
- •Билет 18.
- •Электрохимический ряд напряжений металлов и взаимодействие металлов с растворами кислот и солей.
- •2. Общие сведения о неметаллах. Понятие аллотропии.
- •2. Какой объем кислорода потребуется для сжигания 120мг магния.
- •Билет 19.
- •1. Подгруппа кислорода
- •2. Заполните пропуски в цепочке превращений и запишите уравнения соответствующих этим превращениям реакций:
- •Билет 20.
- •Генетическая связь между классами неорганических веществ.
- •Подгруппа углерода: кислородные соединения углерода и их свойства.
- •2. Сколько граммов воды и нитрата натрия нужно взять, чтобы приготовить 80г 5%-го раствора?
- •Билет 21.
- •Билет 22.
- •1. Теория строения атома.
- •2. Металлы побочных подгрупп. Особенности строения атомов меди, железа, хрома, марганца.
- •Испытайте действие раствора сульфида натрия на универсальной индикаторной бумажке. Укажите среду раствора. Напишите уравнения реакции гидролиза соли по первой стадии.
- •Периодический закон и периодическая система элементов д.И. Менделеева в свете учения о строении атома.
- •Свойства простого вещества железа.
- •Дать характеристику одного из элементов - неметаллов (хлора, серы, фосфора, азота, углерода, кремния) (все по выбору).
- •Периодическая система элементов д.И. Менделеева в свете учения о строении атома.
- •2. Свойства соединений железа.
- •3.Дать характеристику одного из элементов - металлов (натрия, кальция, алюминия или железа) (все по выбору).
- •1. Химические свойства основных оксидов.
- •2. Подгруппа галогенов: строение и свойства атомов.
- •1. Химические свойства кислотных оксидов.
- •Билет 30.
Билет 1.
1. Теория строения атома.
Планетарная модель атома (модель Резерфорда)
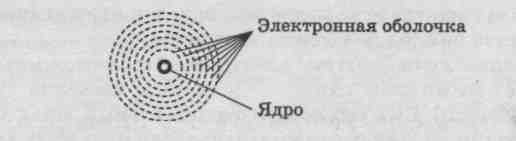
Понятие об электронной оболочке атома и энергетических уровнях
В электронной оболочке различают слои, на которых будут располагаться электроны с различным запасом энергии, поэтому их называют также энергетическими уровнями. Число этих уровней в атоме химического элемента равно соответствующему ему номеру периода в таблице Д. И. Менделеева: у атома А1, элемента 3 периода, -три уровня, а у атома РЬ, элемента 6 периода, — шесть ypoвней. Каждый уровень может вместить в себя определенное максимальное число электронов: 1-й — 2е-, 2-й — 8е-, и, хотя максимальное число электронов, способных поместиться на 3- уровне, равно 18, атомы элементов этого периода могут разместить на нем, подобно атомам элементов 2 периода, только 8е-.
Энергетические уровни, содержащие максимальное числ электронов, называются завершенными. Если они содержа меньшее число электронов, то эти уровни незавершенные.
2. Подгруппа кислорода: строение и свойства атомов, простых веществ, химические свойства серы.
Элементы подгруппы кислорода — кислород О, сера S, селен Se, теллур Те, полонии Ро — имеют общее название «халькогены», что означает «рождающие руды».
Строение и свойства атомов.
Атомы серы, как и атомы кислорода и всех остальных элементов главной подгруппы VI группы Периодической системы Д. И. Менделеева, содержат на внешнем энергетическом уровне 6 электронов, из которых 2 электрона неспаренные.
Простые вещества. Аллотропия кислорода – это простые вещества кислород О2 и озон О3.
Для серы, как и для кислорода, характерна аллотропия. Это ромбическая и пластическая сера.
Химические свойства. 1. По отношению к менее электроотрицательным элементам (водород, металлы) сера проявляет окислительные свойства и приобретает степень окисления -2.При обычных условиях сера реагирует со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром, например:
О 0+2-2
Hg + S = HgS.
2. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, поэтому проявляют более выраженные восстановительные свойства, образуя соединения со степенями окисления +2, +4, +6.Окислительные свойства сера проявляет и с водородом, с которым реагирует при нагревании:
Н2 + S = H2S.
Из неметаллов с серой не реагируют только азот, йод и благородные газы.
Сера горит синеватым пламенем, образуя оксид серы (IV):
S + 02 = S02.
Это соединение широко известно под названием сернистый газ.
3. Расставьте коэффициенты в схемах реакций методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления.
Са + N2 Ca3N2
Си + Н2S04(конц) CuS04+ S02+ H20
Ответ см. в лабораторном журнале - практическая работа № 2.
Билет 2.
1. Открытие д.И. Менделеевым Периодического закона.
Д. И. Менделеев расположил все известные ко времени открытия Периодического закона химические элементы в ряд, по возрастанию их атомных масс и отметил в нем отрезки — периоды, в которых свойства элементов и образованных ими веществ изменялись сходным образом, а именно (в современных терминах):
металлические свойства ослабевали;
неметаллические свойства усиливались;
степень окисления элемента в высших оксидах увеличивалась с +1 до +7;
оксиды от основных через амфотерные сменялись кислотными;
гидроксиды от щелочей через амфотерные гидроксиды сменялись все более сильными кислотами.
На основании этих наблюдений Д. И. Менделеев в 1869 г. сделал вывод — сформулировал Периодический закон:
свойства химических элементов и образованных ими веществ находятся в периодической зависимости от их атомных весов.
