
- •Электродные потенциалы
- •Измерение электродных потенциалов
- •Водородный электрод
- •Гальванические элементы
- •Концентрационный гальванический элемент
- •Окислительно-восстановительные (редокс-) потенциалы
- •Диффузионный потенциал
- •Потенциометрия
- •Электроды I рода
- •Электроды II рода
- •Электроды сравнения
- •Электроды определения (индикаторные)
- •Ионоселективные электроды
Диффузионный потенциал
Протекание многих биологических процессов связано с изменением концентраций ионов в клетках и тканях живых организмов. Неравномерное распределение ионов в какой-либо жидкой среде обычно приводит к возникновению диффузионного потенциала.
Диффузионным называется потенциал, возникающий на границе раздела двух растворов, содержащих один и тот же электролит различной концентрации вследствие различия в подвижности их катионов и анионов.
Рассмотрим процесс, протекающий на границе двух растворов соляной кислоты разной концентрации. При соприкосновении растворов ионы Н+ и Cl− из более концентрированного раствора благодаря диффузии будут перемещаться в разбавленный раствор. Поскольку подвижность ионов Н+ значительно больше, чем ионов Cl−, то в разбавленный раствор в единицу времени ионов Н+ переместится больше, чем ионов Cl−.
В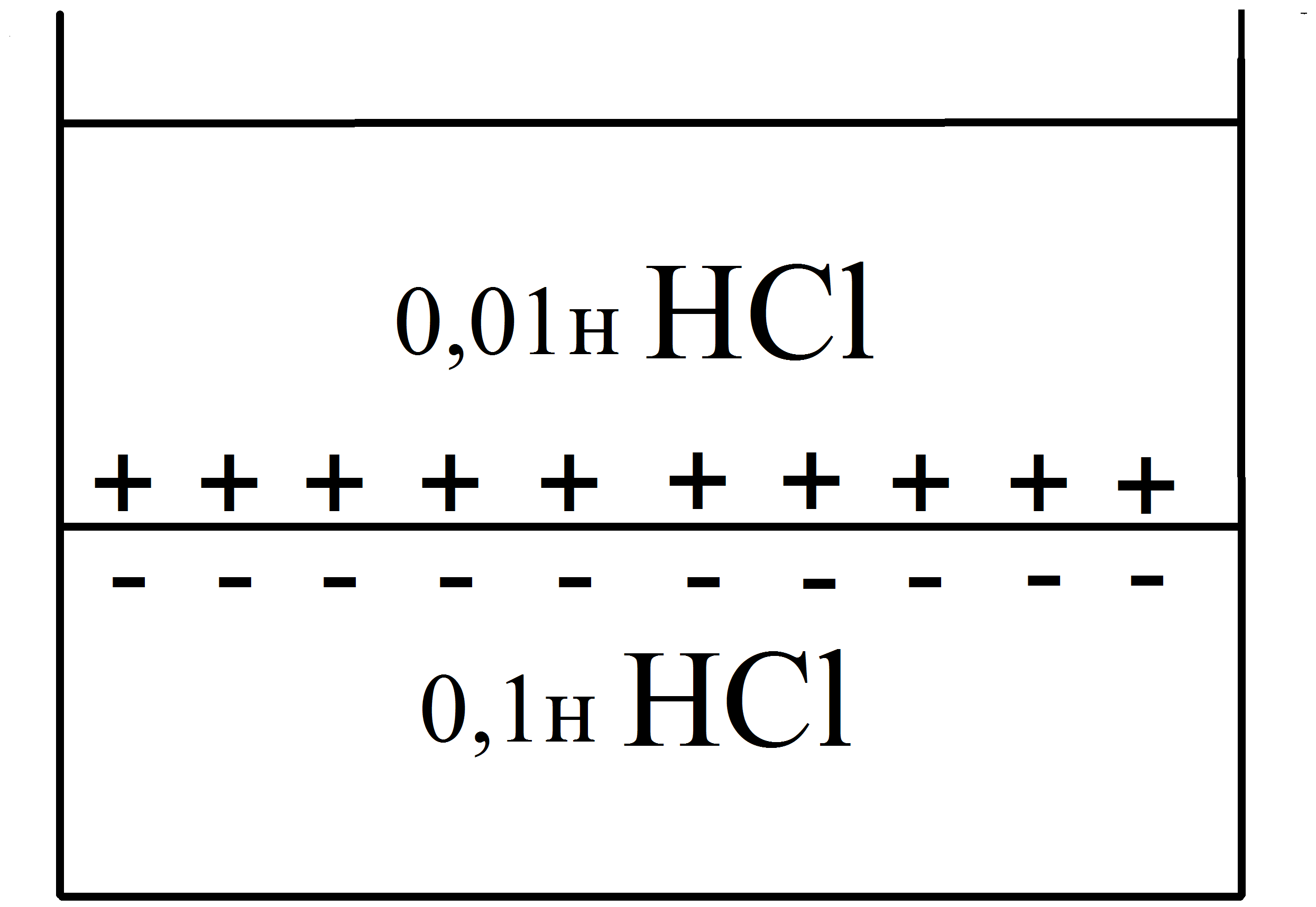 результате этого разбавленный раствор
у поверхности раздела зарядится
положительно за счет более быстрых
ионов (H+),
a концентрированный - отрицательно за
счет медленных ионов (Cl−).
Т.о., на границе раздела двух растворов
НCl
образуется двойной электрический слой,
который постепенно движется в сторону
разбавленного раствора и существует
до тех пор, пока концентрации ионов не
выравнятся по всему объему.
результате этого разбавленный раствор
у поверхности раздела зарядится
положительно за счет более быстрых
ионов (H+),
a концентрированный - отрицательно за
счет медленных ионов (Cl−).
Т.о., на границе раздела двух растворов
НCl
образуется двойной электрический слой,
который постепенно движется в сторону
разбавленного раствора и существует
до тех пор, пока концентрации ионов не
выравнятся по всему объему.
В еличина диффузионного потенциала ЕД обычно невелика и не превышает 0,1 В; если подвижности катионов и анионов близки, то ЕД 0.
В биологических системах диффузионный потенциал проявляется при механическом повреждении клеток. Из места повреждения ионы перемещаются в межклеточную жидкость за счет чего возникает диффузионный потенциал.
Потенциометрия
В фармации для определения концентрации ионов в растворах широко используется метод потенциометрии.
Потенциометрия - это физико-химический метод анализа, позволяющий определить концентрации ионов на основании измерения ЭДС гальванической цепи.
При потенциометрических измерениях гальваническая цепь состоит из электрода сравнения и электрода определения:


 ЭДС
= f[С(х)]
ЭДС
= f[С(х)]
 электрод
исследуемый электрод
электрод
исследуемый электрод
сравнения раствор определения
E = const C(x) - ? E=f[C(x)]
Из этой схемы видно, что результат потенциометрических измерений, т.е. величина ЭДС, зависит, прежде всего, от работы электродов.
Электроды, применяемые в потенциометрии, классифицируются по определенным признакам.
Электроды I рода
К электродам этого типа относятся металлические электроды, находящиеся в растворе своих ионов, они обратимы относительно катионов. Схематически электрод первого рода записывается следующим образом:
Me | Men+. Уравнение для расчета потенциала электрода первого рода при 25° С имеет вид:
![]()
Электроды II рода
Это электроды, обратимые как по отношению к катионам, так и по отношению к анионам. Электроды второго рода по своему устройству представляют собой малоактивный металл, покрытый слоем собственного труднорастворимого электролита, опущенный в раствор хорошо растворимого электролита с одноименными анионами. Схематически его изображают следующим образом: Me, MeA | Аn−. Уравнение Нернста при 25°С для электродов II рода имеет вид:
![]()
