
- •Электродные потенциалы
- •Измерение электродных потенциалов
- •Водородный электрод
- •Гальванические элементы
- •Концентрационный гальванический элемент
- •Окислительно-восстановительные (редокс-) потенциалы
- •Диффузионный потенциал
- •Потенциометрия
- •Электроды I рода
- •Электроды II рода
- •Электроды сравнения
- •Электроды определения (индикаторные)
- •Ионоселективные электроды
Концентрационный гальванический элемент
Элементы этого типа состоят из электродов, сделанных из одного и того же металла, но опущенных в растворы солей с различной концентрацией, из-за чего величины потенциалов этих электродов - будут разными. Чем больше в растворе концентрация ионов металла, тем больше вероятность их перехода в кристаллическую решетку металла и тем положительнее должен быть потенциал металлического электрода. Поэтому катодом (+) будет электрод, опущенный в раствор с большей концентрацией соли, например:
(-)Ag | AgNO3 || AgNO3 | Ag(+)
С1 < С2
Благодаря различию в концентрациях солей в растворах при замкнутых внешней и внутренней цепи в этом гальваническом элементе будут протекать следующие реакции:
а нод Ag - е Ag+
к атод Ag+ + е Ag0.
ЭДС концентрационного элемента при 298К будет равен:
![]()
где n - заряд ионов металла.
Т.о., ЭДС зависит от соотношения концентраций ионов металла в растворах и не зависит от природы металла.
При работе концентрационного гальванического элемента происходит выравнивание концентраций его растворов, и поэтому ЭДС постоянно уменьшается.
Окислительно-восстановительные (редокс-) потенциалы
Скачок потенциала на электроде может возникать в результате окислительно-восстановительной реакции, протекающей в приэлектродном пространстве. Если в растворе одновременно содержатся окисленная и восстановленная формы одного и того же вещества, например Fe3+ и Fe2+, то обмен электроном между окисленной (Fe3+) и восстановленной (Fe2+) формами в результате реакции Fe3+ + ē Fe2+ происходит через посредника. В качестве посредника используют инертный металл - платину. Платина способствует перераспределению электронов между восстановленной и окисленной формами данной системы. Ионы Fe2+ отдают электроны на платину, а затем они переходят на ионы Fe3+. Инертный металл не принимает участия в электродной реакции, а является переносчиком электронов. Переход электронов с Fe2+ на платину энергетически более выгоден, чем от иона Fe2+ к Fe3+ в растворе. Обмен электронами между восстановленной и окисленной формами через платину сопровождается появлением на границе раздела фаз платина - раствор двойного электрического слоя (ДЭС). Возникновение ДЭС в этом случае не связано с природой металла, а вызывается различием в способности восстановленной формы отдавать электроны посреднику, а окисленной формы - принимать электроны от посредника.
У словная запись окислительно-восстановительного электрода.
 Fe3+
Fe3+
Pt —
Fe2+
При погружении инертного металла в раствор, содержащий избыток окисленной формы C(Fe3+)>>(Fe2+) металлическая поверхность заряжается положительно. При избытке восстановленной формы C(Fe3+)<<C(Fe2+) поверхность платины заряжается отрицательно (учебник Ершова, с. 480).

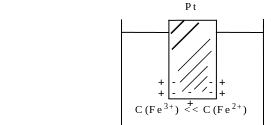

+
+
-
-
+
+
-
-
![]()
![]()
Т.о. окислительно-восстановительный потенциал - это потенциал, который возникает на электроде из инертного металла, погруженного в раствор, который содержит одновременно окисленную и восстановленную формы одного и того же вещества.
На величину окислительно-восстановительного потенциала влияет:
природа окислительно-восстановительной пары,
соотношение концентраций окисленной и восстановленной форм в растворе, температура.
Потенциал окислительно-восстановительного электрода при 298 К рассчитывают по уравнению Петерса:
![]()
где n - число электронов, участвующих в обратимом окислительно-восстановительном процессе, протекающем на электроде.
Сокисл., Свосст. - концентрации окисленной и восстановленной форм вещества в растворе,
E0ок.\восст. - стандартный окислительно-восстановительный потенциал.
Стандартный окислительно-восстановительный потенциал — это потенциал, возникающий на границе раздела инертный металл — раствор, в котором концентрация окисленной формы равна концентрации восстановленной формы.
Величина стандартного окислительно-восстановительного потенциала является мерой окислительной способности данной системы. Чем больше положительное значение Eок.\восст., тем сильнее выражены окислительные свойства окисленной формы данной системы, т.е. способность присоединять электроны.
