
- •Электродные потенциалы
- •Измерение электродных потенциалов
- •Водородный электрод
- •Гальванические элементы
- •Концентрационный гальванический элемент
- •Окислительно-восстановительные (редокс-) потенциалы
- •Диффузионный потенциал
- •Потенциометрия
- •Электроды I рода
- •Электроды II рода
- •Электроды сравнения
- •Электроды определения (индикаторные)
- •Ионоселективные электроды
Электродные потенциалы
Механизм возникновения электродного потенциала
Если пластинку металла, например цинка, погрузить в воду, то расположенные на поверхности катионы металла гидратируются полярными молекулами воды, при этом выделяется энергия гидратации, которая идет на разрыв связи ионов в кристаллической решетке металла. Часть ионов цинка, расположенных на поверхности, перейдет в воду. Сама пластинка при этом зарядится отрицательно. Ионы Zn2+ из раствора электростатически притягиваются к пластинке, образуется двойной электрический слой (ДЭС). (рис.1):


Если же металл помещен в раствор собственной соли, например, ZnSO4, то в раствор поступит меньше ионов Zn2+ из металла.
Пластинка металла заряжается отрицательно, если энергия гидратации больше, чем энергия кристаллической решетки (учебник Ершова, с.469; учебник Ленского, с.234).
Е![]() сли
же медную пластинку погрузить в раствор
CuSO4,
то ионы Сu2+
осаждаются на ней. Пластинка заряжается
положительно, в растворе создается
избыток анионов. Ионы электростатически
притягиваются к пластинке, образуется
двойной электрический слой.
сли
же медную пластинку погрузить в раствор
CuSO4,
то ионы Сu2+
осаждаются на ней. Пластинка заряжается
положительно, в растворе создается
избыток анионов. Ионы электростатически
притягиваются к пластинке, образуется
двойной электрический слой.
( рис.2)
рис.2)
Металлы, стоящие в электрохимическом ряду напряжений правее водорода, заряжаются положительно, левее водорода - отрицательно.
Система, состоящая из двух токопроводящих тел: проводников 1 - го рода (металлов), погруженных е растворы собственных солей (проводник 2-го рода) — называется электродом.
Условное обозначение электрода в общем виде Me | Меn+. Вертикальная черта показывает границу раздела между проводником 1-го рода и проводником 2-го рода.
Условное обозначение цинкового электрода: Zn | ZnSO4 или Zn | Zn2+; медного электрода: Си | CuSO4 или Сu | Сu2+.
Скачок потенциала, возникающий на границе раздела металл-раствор его соли, называется электродным потенциалом.
Он
обозначается
![]() ,
например:
,
например:
![]() .
.
Гидратированные катионы металла в растворе, одноименные с металлом электрода, влияющие на величину его потенциала, называются потенциалопределяющими.
Чтобы можно было сравнить значения электродных потенциалов различных металлов, следует работать в стандартных условиях: Т = 298 К;
концентрация ионов 1 моль/л; Р = 1 атм.
Измерение электродных потенциалов
Электродный потенциал отдельного электрода не поддается непосредственному измерению, поскольку возникает между разными фазами - металлом и раствором его соли. Всякая замкнутая цепь должна обязательно включать два электрода. На практике потенциалы всех электродов измеряются по отношению к некоему общему электроду - стандартному водородному электроду потенциал которого при 298 K, давлении 1 атм и концентрации ионов водорода 1 моль/л принят равным нулю.
Водородный электрод
Водородный электрод состоит из платиновой пластинки, покрытой платиновой чернью (для увеличения активной поверхности электрода) и погруженный в раствор, содержащей катионы водорода, обычно раствор HCl или H2SO4, На пластинку подается ток водорода, который поглощается платиной (учебник Ершова, с. 472).
(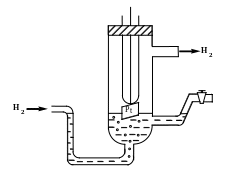 рис.3)
рис.3)
Водород, растворенный в платине, частично, под действием силовых полей атомов платины, диссоциирует на протоны и электроны:
H

![]() 2
2H+
+ 2е. В результате такая платиновая
пластина приобретает способность
обмениваться с раствором ионами водорода.
Условное обозначение водородного
электрода Pt(H2)
| 2Н+.
Электродный потенциал возникает на
границе Pt- раствор кислоты и обозначается
.
2
2H+
+ 2е. В результате такая платиновая
пластина приобретает способность
обмениваться с раствором ионами водорода.
Условное обозначение водородного
электрода Pt(H2)
| 2Н+.
Электродный потенциал возникает на
границе Pt- раствор кислоты и обозначается
.
Е![]() сли
водородный электрод находится в
стандартных условиях (Т = 298 К, СH+
= 1 моль/л, Р = 1 атм), он называется
стандартным
водородным
электродом.
Потенциал стандартного водородного
электрода условно принят равным нулю:
.
сли
водородный электрод находится в
стандартных условиях (Т = 298 К, СH+
= 1 моль/л, Р = 1 атм), он называется
стандартным
водородным
электродом.
Потенциал стандартного водородного
электрода условно принят равным нулю:
.
М
еталлический
электрод соединяют проводником с
водородным электродом (оба электрода
находятся в стандартных условиях) и
измеряют ЭДС цепи: ЭДС = Е+
- E–
, где E+
и Е–
потенциалы положительного и отрицательного
электродов. Т.к. , то ЭДС будет равна
электродному потенциалу данного металла.
Такой электродный потенциал называется
стандартным электродным потенциалом
и обозначается
![]() .
.
Стандартный электродный потенциал численно равен электродвижущей силе со знаком «+» или «-» гальваническою элемента, составленного из стандартного водородного и стандартного данного электродов.
Стандартные электродные потенциалы распространенных металлов в водных растворах при 25 °С представлены в соответствующих таблицах.
Последовательность металлов по возрастанию стандартного потенциала Е0 (от больших отрицательных к большим положительным значениям) называется рядом стандартных электродных потенциалов или электрохимическим рядом напряжений. У металлов, стоящих до водорода, стандартные электродные потенциалы отрицательные. После водорода - положительные.
Таким образом, при стандартных условиях электродные потенциалы имеют определенные стандартные значения. Величины стандартных электродных потенциалов количественно характеризуют восстановительную способность металлов и окислительную способность их ионов. Так, Li - самый сильный восстановитель, а Аu - самый слабый, и наоборот, ион Аu3+ - самый сильный окислитель, а ион Li+ - самый слабый.
Для условий отличных от стандартных (иная концентрация электролита и иная температура) электродные потенциалы будут иметь другие значения. Их можно рассчитать по уравнению Нернста (немецкий физик, 1888г):
![]()
где
![]() - электродный потенциал метала.
- электродный потенциал метала.
![]() - стандартный
электродный потенциал металла,
- стандартный
электродный потенциал металла,
R - универсальная газовая постоянная, равная 8,31 Дж/моль*К,
Т - абсолютная температура, К.
n - заряд ионов металлов.
F - число Фарадея, равное 96500 Кл/моль,
ln - натуральный логарифм,
а - активность ионов металла в растворе, моль/л.
Таким образом, величина электродного потенциала зависит от природы металла (E0), активности ионов металла в растворе и температуры.
В разбавленных растворах активность примерно равна молярной концентрации а ≈ с.
Для расчетов при температуре 298 К (25 °С), подставив константы R, F и умножив значение ln на 2,3 (коэффициент перехода от натуральных логарифмов к десятичным), получают уравнение Нернста в следующей форме:
![]()
Пример. Потенциал медного электрода (n = 2) в растворе CuCl2 с концентрацией ионов меди С = 0,001 моль/л равен:

З![]() апишем
уравнение Нернста, для водородного
электрода, находящегося в нестандартных
условиях СH
≠ 1 моль/л при 298° К:
апишем
уравнение Нернста, для водородного
электрода, находящегося в нестандартных
условиях СH
≠ 1 моль/л при 298° К:
По этой формуле, зная величину электродного потенциала водородного электрода, находящегося в исследуемом растворе, можно рассчитать рН этого раствора. Однако для серийных измерений водородный электрод не применяется в силу громоздкой конструкции и чувствительности к посторонним веществам и каталитическим ядам.
