
- •Содержание
- •1. Характеристика дисперсных систем
- •1.1 Коллоидное состояние вещества
- •1.2 Растворы высокомолекулярных соединений
- •1.3 Классификация дисперсных систем
- •2. Электрические свойства дисперсных систем
- •2.1 Возникновение двойного электрического слоя
- •2.2 Строение двойного электрического слоя
- •2.4.Электрокинетические явления
- •3. Получение дисперсных систем
- •3.1 Метод диспергирования
- •3.2 Метод пептизации
- •3.3 Метод конденсации
- •3.4 Строение мицеллы
- •4. Устойчивость и коагуляция дисперсных систем
- •4.1 Факторы устойчивости дисперсных систем
- •4.2 Расклинивающее давление
- •4.3 Основные положения теории длфо
- •4.4 Закономерности коагуляции дисперсных систем электролитами
- •5. Лабораторные работы Работа 2.1 получение коллоидных растворов методом конденсации
- •Реакции восстановления
- •Реакции обмена
- •Реакции гидролиза
- •Работа 2.2 коагуляция лиозоля канифоли электролитами
- •Вариант 2 Исходные коллоидные растворы:
- •Вариант 3
1.1 Коллоидное состояние вещества
Наиболее типичным представителем дисперсных систем, вобравшим в себя все многообразие свойств, характерных для гетерогенных систем, являются коллоидные системы.
Коллоидной системой называют дисперсную систему с предельно высокой степенью раздробленности (а < 10-7 м) и соответственно максимальной удельной поверхностью. При такой дисперсности основная часть вещества фазы составляет поверхностный слой. Атомы и молекулы в поверхностных слоях образуют особую структуру, а вещество принимает особое состояние, отличающееся по свойствам от его состояния в объемах фаз: температурой плавления, кипения, реакционной способностью и другими свойствами. Состояние вещества в поверхностных слоях, характеризуемое особыми свойствами, называют коллоидным состоянием. Таким образом, в коллоидных системах практически вся дисперсная фаза находится в коллоидном состоянии, что обусловливает возникновение качественно новых свойств, в которых решающая роль принадлежит поверхностным явлениям. Исторически сложилось, что коллоидные системы называют золями или коллоидными растворами.
Молекулы, расположенные на границе раздела фаз, обладают избытком свободной энергии. Термодинамической характеристикой межфазной поверхности является поверхностное натяжение σ (Дж/м2) - свободная энергия единицы поверхности. Естественно, чем больше поверхность раздела S между фазами, тем больше ее избыточная свободная энергия:
G=σS. |
(1.1) |
Следовательно, все дисперсные, и особенно коллоидные системы, обладают большим запасом свободной поверхностной энергии.
Системы с большим запасом свободной энергии неустойчивы, термодинамически неравновесны, в них будут самопроизвольно протекать процессы, сопровождающиеся уменьшением запаса свободной энергии. Поэтому все дисперсные, в том числе и коллоидные системы принципиально термодинамически неравновесны, в них всегда самопроизвольно протекают такие процессы как укрупнение частиц - коагуляция (слипание, агрегация), и коалесценция (слияние) частиц, т.е. процессы приводящие к уменьшению межфазной поверхности S. Системы, в которых коагуляция идет с большой скоростью, называют агрегативно неустойчивыми.
Из определения величины свободной энергии (1.1) видно, что минимум G может быть достигнут и за счет снижения поверхностного натяжения σ. Следовательно, процессы, снижающие поверхностное натяжение, также являются самопроизвольными. Один из таких процессов - адсорбция - лежит в основе получения агрегативно устойчивых дисперсных систем в присутствии стабилизатора. Вещество стабилизатора, адсорбируясь на поверхности частиц, создает защитный слой, препятствующий коагуляции.
1.2 Растворы высокомолекулярных соединений
Объектами коллоидной химии наряду с дисперсными гетерогенными системами являются растворы сильно ассоциирующих веществ и высокомолекулярных соединений, которые при определенных условиях могут образовывать ассоциативные или макромолекулярные гетерогенные системы. Размеры макромолекул или ассоциатов могут превышать размеры обычных коллоидных частиц. Эти системы обладают многими свойствами , характерными для типичных гетерогенных дисперсных систем.
К высокомолекулярным соединениям (ВМС) относят вещества, с относительной молекулярной массой от десяти тысяч до нескольких миллионов. Размеры макромолекул ВМС в вытянутом состоянии соизмеримы с размерами частиц ульрамикрогетерогенных дисперсных систем (10-7 м и более). ВМС, состоящие из большого числа повторяющихся одинаковых звеньев, называются полимерами. Однако, как правило, к полимерам относят все ВМС.
По строению макромолекулярной цепи различают три вида полимеров: линейные, разветвленные и сшитые (пространственные). В растворах полимеров, как и в золях, макромолекулы (частицы) находятся в тепловом движении. Большие молекулы полимеров обладают определенной гибкостью (особенно линейные молекулы), и при комнатной температуре молекулы большинства полимеров имеют форму клубка. В «хороших» растворителях макромолекула полимера предельно вытянута, число степеней свободы ее минимально, и растворы полимеров ближе к однофазным системам. В «плохих» растворителях макромолекула свернута в компактную глобулу (клубок), и ее можно рассматривать как частицу отдельной фазы. При формировании глобул происходит определенное ориентирование углеводородных цепей и полярных групп, т.е. обеспечивается минимальное межфазное натяжение на границе макромолекула - среда. При таком состоянии молекул растворы полимеров проявляют практически все свойства коллоидных (гетерогенных) систем.
Так как соответствующие гетерогенным системам свойства характерны для очень разбавленных растворов, в которых полимер находится в виде отдельных молекул, то тем более это характерно для концентрированных растворов. В растворах обычных концентраций макромолекулы объединяются в ассоциаты (по аналогии с коллоидным раствором - в мицеллы), образуя новую фазу.
Особый вид дисперсной системы с полимерной дисперсной фазой составляют латексы. Латексы представляют собой стабилизированный лиозоль полимера. Натуральный латекс (млечный сок каучуконосных растений) - это водная дисперсия натурального каучука. Частицы натурального каучука размером от 0,25 до 5 мкм, окружены поверхностным слоем, состоящим из белковых веществ и природных ПАВ, придающих системе агрегативную устойчивость.
Синтетические латексы получают эмульсионной полимеризацией мономера, растворенного (солюбилизированного) в мицелле ПАВ.
Растворы полимеров в родственных растворителях представляют собой гомогенные системы, неограниченно устойчивые и термодинамически равновесные. Однако процесс растворения полимеров обладает рядом особенностей, отличающих его от растворения низкомолекулярных веществ. Во-первых, он протекает в течение достаточно большого промежутка времени; во-вторых, первой стадией процесса растворения является набухание полимера в растворителе.
Набуханием называют проникновение молекул низкомолекулярного растворителя между молекулами полимера и связанное с этим раздвижение звеньев и цепей высокомолекулярного соединения, приводящее к увеличению объема и массы образца. Набухание характерно именно для высокомолекулярных соединений. В результате набухания их масса и объем могут увеличиваться в десятки раз. Низкомолекулярные соединения обладают жесткой структурой, плотной упаковкой молекул и практически не набухают. Они могут удерживать жидкость в порах в основном вследствие адсорбции и капиллярных явлений; при этом их объем не меняется.
Набухание - это осмотический процесс, при котором происходит диффузия молекул растворителя в полимер. Набухание предшествует растворению полимеров по той причине, что скорость диффузии молекул низкомолекулярной жидкости значительно превосходит скорость диффузии огромных молекул полимера. Поэтому вначале практически имеет место процесс односторонней диффузии молекул растворителя в полимер.
Различают два вида набухания: неограниченное, заканчивающееся полным растворением, и ограниченное, приводящее к образованию набухшего полимера — геля (студня).
Гель это однофазная система, состоящая из пространственной сетки молекул полимера и молекул растворителя, заполняющих пустоты в этой сетке. Эту систему можно назвать раствором низкомолекулярного вещества в высокомолекулярном. Продолжительность растворения полимера объясняется тем, что скорость диффузии огромных и разветвленных молекул полимера очень мала и для установления равновесия в растворе требуется длительное время.
Различают межструктурное и внутриструктурное набухание. При межструктурном набухании молекулы полимера, диффундируя в полимер занимают свободное пространство прежде всего между элементами надмолекулярных структур. Если полимер и растворитель близки по природе, молекулы растворителя проникают также внутрь надмолекулярных образований, раздвигая сначала отдельные участки макромолекул, а затем и целиком длинные полимерные цепи (внутриструктурное набухание). Именно внутриструктурное набухание сопровождается значительным увеличением объема полимера. При этом расстояние между макромолекулами увеличивается, связи между ними ослабляются, начинается диффузия макромолекул полимера в растворитель; набухание переходит в растворение.
Количественной
характеристикой набухания является
степень набухания
![]() .
Степень набухания характеризуется
массой жидкости, поглощенной единицей
массы вещества при данной температуре:
.
Степень набухания характеризуется
массой жидкости, поглощенной единицей
массы вещества при данной температуре:
|
1.2 |
где mo и m1 масса образца до и после набухания.
Кинетику процесса набухания отражает зависимость степени набухания от времени. Типичные кинетические кривые набухания представлены на рис.1.1. Кривые 2 и 3 характеризует ограниченное набухание, причем кривая 2 соответствует сравнительно быстро набухающему полимеру, но с малым значением предельного набухания, а кривая 3 - медленно набухающему полимеру с большим значением предельного набухания. Как видно из рис.1.1, кривые 2, 3, степень набухания вначале растет быстро, а затем плавно достигает максимального значения и в дальнейшем не зависит от времени набухания. Аналитически эти кривые можно представить дифференциальным уравнением:
|
1.3 |
где
max-
степень предельного набухания;
![]() -
степень набухания к моменту времени
-
степень набухания к моменту времени
![]() ;
k
- константа скорости набухания, зависящая
от природы полимера, растворителя и
температуры.
;
k
- константа скорости набухания, зависящая
от природы полимера, растворителя и
температуры.
В результате интегрирования уравнение (1.3) принимает вид:
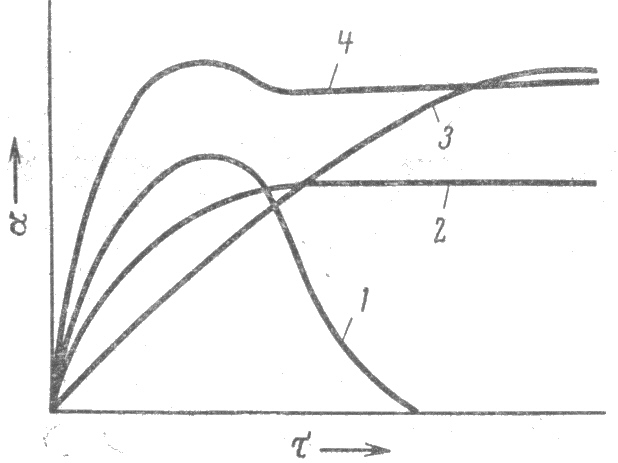
Рис.1.1. Типы кинетических кривых набухания:
1 - неограниченное набухание;
2, 3 - ограниченное набухание с разным значением предельного набухания;
4 - ограниченное набухание с растворением низкомолекулярных фракций
|
1.4 |
Скорости набухания различных полимеров надо сравнивать по наклону касательных, проведенным к кривым из начала координат, а способность полимеров к набуханию следует характеризовать по предельной степени набухания.
Кривая 1 на рис. 1.1 характеризует процесс, когда полимер растворяется в растворителе, это неограниченное набухание. В этом случае о достижении предела набухания говорить нельзя, хотя на кривой и имеется максимум.
Кривая 4 (рис. 1.1) иллюстрирует набухание, когда из набухающего полимера экстрагируется значительное количество низкомолекулярных фракций, в результате чего степень набухания уменьшается.
При набухании часто наблюдается явление контракции. Контракция - это уменьшение объема всей системы при набухании (в то время как объем полимера всегда увеличивается). Контракция системы при набухании объясняется ориентацией молекул растворителя в процессе сольватации макромолекул ВМС, при этом плотность системы увеличивается. Кроме того, при набухании молекулы растворителя проникают в промежутки между большими макромолекулами, вследствие чего компактность упаковки возрастает.
Набухание
и растворимость полимеров зависит от
многих факторов. Температура и давление
влияют на эти процессы в соответствии
с принципом смещения равновесия Ле
Шателье. Если набухание сопровождается
выделением теплоты (![]() ),
то с повышением температуры степень
набухания уменьшается, при этом скорость
набухания растет, так как увеличивается
скорость диффузии. Вследствие того, что
объем системы при набухании уменьшается
(контракция) увеличение давления приводит
к повышению степени набухания.
),
то с повышением температуры степень
набухания уменьшается, при этом скорость
набухания растет, так как увеличивается
скорость диффузии. Вследствие того, что
объем системы при набухании уменьшается
(контракция) увеличение давления приводит
к повышению степени набухания.
Набуханию способствуют близость полимера и растворителя по природе, гибкость цепи полимера, наличие функциональных групп. У амфотерных полиэлектролитов степень набухания и растворимость зависят от рН раствора, Наименьшее набухание и растворимость отвечают изоэлектрической точке ИЭТ (значение рН, при котором средний суммарный заряд макромолекул полимера равен нулю). Выше и ниже этой точки степень набухания и растворимость увеличиваются (рис. 1.2).
Р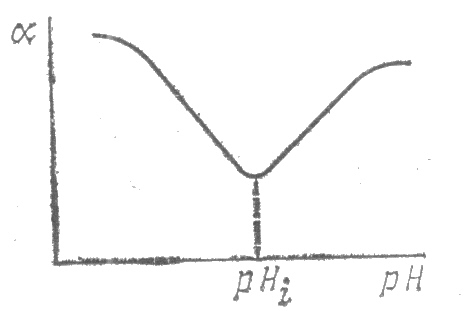 ис.
1.2. Зависимость степени набухания
амфотерных полиэлектролитов от рН
раствора.
ис.
1.2. Зависимость степени набухания
амфотерных полиэлектролитов от рН
раствора.
Значительное влияние на набухание полимера оказывает присутствие неорганических электролитов. В этом случае степень набухания снижается, во-первых, вследствие уменьшения активности растворителя, а во-вторых (для полимеров-полиэлектролитов), сказывается влияние противоиона, с повышением концентрации которого наоборот увеличивается активность полимера, и, следовательно, уменьшается степень набухания.
