
- •Содержание
- •1. Характеристика дисперсных систем
- •1.1 Коллоидное состояние вещества
- •1.2 Растворы высокомолекулярных соединений
- •1.3 Классификация дисперсных систем
- •2. Электрические свойства дисперсных систем
- •2.1 Возникновение двойного электрического слоя
- •2.2 Строение двойного электрического слоя
- •2.4.Электрокинетические явления
- •3. Получение дисперсных систем
- •3.1 Метод диспергирования
- •3.2 Метод пептизации
- •3.3 Метод конденсации
- •3.4 Строение мицеллы
- •4. Устойчивость и коагуляция дисперсных систем
- •4.1 Факторы устойчивости дисперсных систем
- •4.2 Расклинивающее давление
- •4.3 Основные положения теории длфо
- •4.4 Закономерности коагуляции дисперсных систем электролитами
- •5. Лабораторные работы Работа 2.1 получение коллоидных растворов методом конденсации
- •Реакции восстановления
- •Реакции обмена
- •Реакции гидролиза
- •Работа 2.2 коагуляция лиозоля канифоли электролитами
- •Вариант 2 Исходные коллоидные растворы:
- •Вариант 3
Работа 2.2 коагуляция лиозоля канифоли электролитами
Цель работы: установить влияние природы и концентрации электролита на устойчивость лиозоля канифоли; установить зоны устойчивости и коагуляции (интервалы концентраций электролита); определить пороги коагуляции.
Лиозоль – это коллоидная система с твердой дисперсной фазой и жидкой дисперсионной средой. Лиозоли относят к ультрамикрогетерогенным , т.е. высокодисперсным системам. Агрегативно устойчивый лиозоль канифоли получают методом замены растворителя: спиртовый раствор канифоли смешивают при интенсивном встряхивании с водой. Получается золь канифоли в воде с отрицательно заряженными коллоидными частицами.
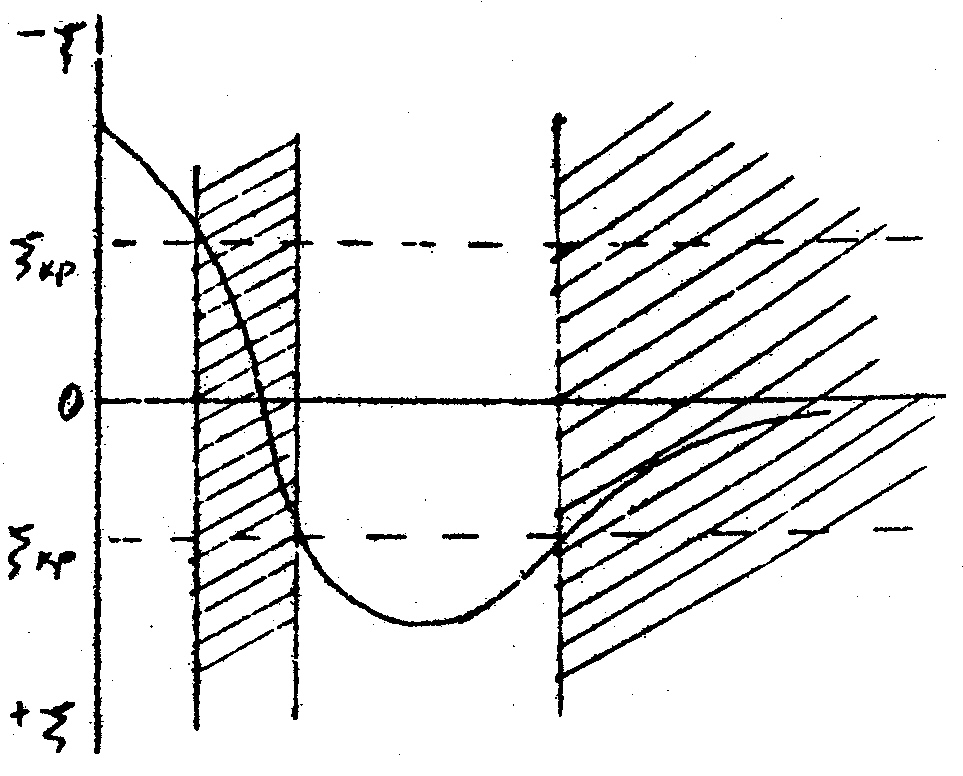
Агрегативная устойчивость золя канифоли обеспечивается прежде всего наличием на поверхности дисперсных частиц двойного электрического слоя. Элементарная частица такого золя называется мицеллой. Толщина диффузного слоя сильно зависит от концентрации электролита в системе. При высоких концентрациях электролита двойной электрический слой сжимается и перестает быть фактором устойчивости коллоидной системы, электрокинетический потенциал ( дзета-потенциал ) при этом уменьшается. При концентрации электролита равной порогу коагуляции дзета-потенциал достигает критического значения ζкр и происходит разрушение золя – коагуляция (выпадение осадка, расслоение системы).
При введении многозарядных ионов экспериментально определяются два порога коагуляции и, соответственно, две зоны коагуляции и две зоны устойчивости. Это можно объяснить тем, что с увеличением концентрации выше первого порога коагуляции все диффузные противоионы переходят в адсорбционный слой ( ζ = 0 ). Более того, при дальнейшем увеличении концентрации электролита многозарядные ионы адсорбируются в плотной части в избытке, в результате чего происходит перезарядка поверхности дисперсной фазы. Формируется новый двойной электрический слой, который является фактором устойчивости в интервале концентраций ск1 < c < ск2, а |ζ| > |ζкр|.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
1. Подготовить и пронумеровать 22 пробирки.
2. С помощью бюретки в пробирки налить по 5 мл золя канифоли.
3. В мерный цилиндр налить 10 мл заданного преподавателем электролита с исходной концентрацией 1 моль/л.
4. С помощью пипетки из мерного цилиндра отобрать 5 мл электролита и поместить его в пробирку под номером 22.
5. В мерный цилиндр с электролитом добавить 5 мл дистиллированной воды и перемешать.
6. С помощью пипетки из мерного цилиндра отобрать 5 мл разбавленного вдвое электролита и поместить его в пробирку
под номером 21.
7. Последовательно разбавляя электролит вдвое, таким образом заполнить все пробирки с золем канифоли.
8. Содержимое пробирок перемешать и оставить не менее чем
на 24 часа.
9. На следующем занятии осмотреть пробирки, результаты осмотра каждой пробирки, начиная с № 1, записать в таблицу, отмечая коагуляцию (осадок, хлопья, расслоение) знаком «+», отсутствие коагуляции - знаком «-»
10.Построить
зависимости дзета-потенциала от
концентрации электролитов
![]() ,
для чего произвольно выбрать значение
ζисх
и ζкр
,
для чего произвольно выбрать значение
ζисх
и ζкр
11.
Рассчитать отношения экспериментально
определенных порогов коагуляции для
электролитов с зарядами противоионов
1, 2 и 3
![]() и сравнить их с соотношением по
эмпирическому правилу Шульце-Гарди.
и сравнить их с соотношением по
эмпирическому правилу Шульце-Гарди.
Таблица
Номер пробирки |
Концентрация электролита |
Результаты наблюдений |
||
NaCl |
MgCl2 |
AlCl3 |
||
|
|
|
|
|
Работа 2.3 ВЗАИМНАЯ КОАГУЛЯЦИЯ ЗОЛЕЙ.
Взаимная коагуляция наблюдается при смешении двух разнородных золей, это так называемая гетерокоагуляция. Взаимная коагуляция характерна в основном для систем, коллоидные частицы которых имеют заряды противоположного знака. Перекрытие диффузных слоев разноименно заряженных золей приводит к притяжению коллоидных частиц и коагуляции коллоидных растворов. В этом случае коагуляция происходит тем полнее, чем полнее произойдет нейтрализация зарядов частиц. Полная гетерокоагуляция произойдет при таком объемном соотношении дисперсных систем, когда суммарный заряд частиц одного золя станет равным по величине суммарному заряду частиц другого золя. Соотношение объемов зависит от различных факторов, например, от дисперсности, природы и заряда ионов двойного электрического слоя. При избытке одного из золей ионы перераспределяются, образуя измененные двойные слои вокруг агрегированных частиц. В этом случае возникает устойчивая система со знаком заряда частиц того золя, который имеется в избытке. По типу гетерокоагуляции происходит нарушение устойчивости при водоподготовке и очистке сточных вод. В воду добавляют, например, соли алюминия, железа, магния, и частицы загрязняющих веществ выпадают в осадок. В этом случае коагуляция обусловлена как снижением электростатического барьера при сжатии двойного слоя (коагулируют однородные частицы), так и, в основном, гетерокоагуляцией. Соли алюминия и железа в результате гидролиза образуют малорастворимые в воде гидроксиды, частицы которых приобретают положительный заряд (взаимодействие с ионами водорода):
Al3++3H2O Al(OH)3(тв)+3H+
Fe3++3H2O Fe(OH)3(тв)+3H+
Вновь образовавшийся золь гидроксида металла и исходная дисперсная система взаимно коагулируют. Кроме того, гидроксиды выделяются на частицах примесей, что также способствует укрупнению частиц. В результате гетерокоагуляции образуются в основном рыхлые осадки - частицы коагулируют во вторичном энергетическом минимуме (частицы непосредственно не контактируют между собой, их разделяет прослойка дисперсионной среды).
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
Вариант1
Исходные коллоидные растворы:
- лиозоль гидроксида железа (с положительно заряженными частицами), полученный в результате гидролиза хлорного железа (при избытке FeCl3);
- лиозоль берлинской лазури (с отрицательно заряженными частицами), полученный реакцией обмена между хлорным железом и железистосинеродистым калием K4[Fe(CN)6] при избытке K4[Fe(CN)6.
1. В пробирки налить последовательно золь гидроокиси железа и золь берлинской лазури в количествах, указанных в табл.1. Содержимое пробирок перемешать.
2. Через 30 мин осмотреть пробирки; результат осмотра отметить в табл.1 (наличие коагуляции – знаком «+», отсутствие – знаком «-»; для устойчивых золей отметить окраску).
3. Определить знак заряда частиц в смеси устойчивых золей (до коагуляции и после коагуляции).
Таблица
-
Номер пробирки
Объем золя гидроксида железа, мл
0бьем золя берлинской лазури, мл
Результаты наблюдений
Знак заряда частиц
1
2
3
4
5
6
10,0
9,0
8,0
6,0
4,0
2,0
0,5
1,0
2,0
4,0
6,0
8,0
Форма отчета:
написать реакции получения исходных коллоидных растворов;
написать формулы мицелл исходных золей;
определить соотношение объемов заданных золей при наиболее полной взаимной коагуляции
рассчитать концентрации золей, при которых наблюдается наиболее полная коагуляция;
объяснить предполагаемый механизм взаимной коагуляции; сделать вывод по результатам эксперимента.
