
- •Содержание
- •1. Характеристика дисперсных систем
- •1.1 Коллоидное состояние вещества
- •1.2 Растворы высокомолекулярных соединений
- •1.3 Классификация дисперсных систем
- •2. Электрические свойства дисперсных систем
- •2.1 Возникновение двойного электрического слоя
- •2.2 Строение двойного электрического слоя
- •2.4.Электрокинетические явления
- •3. Получение дисперсных систем
- •3.1 Метод диспергирования
- •3.2 Метод пептизации
- •3.3 Метод конденсации
- •3.4 Строение мицеллы
- •4. Устойчивость и коагуляция дисперсных систем
- •4.1 Факторы устойчивости дисперсных систем
- •4.2 Расклинивающее давление
- •4.3 Основные положения теории длфо
- •4.4 Закономерности коагуляции дисперсных систем электролитами
- •5. Лабораторные работы Работа 2.1 получение коллоидных растворов методом конденсации
- •Реакции восстановления
- •Реакции обмена
- •Реакции гидролиза
- •Работа 2.2 коагуляция лиозоля канифоли электролитами
- •Вариант 2 Исходные коллоидные растворы:
- •Вариант 3
4.4 Закономерности коагуляции дисперсных систем электролитами
С позиций теории ДЛФО типичные лиофобные системы агрегативно устойчивы благодаря проявлению электростатического фактора устойчивости и коагулируют при введении сравнительно небольших количеств любых электролитов. Наименьшая концентрация электролита см, при которой начинается коагуляция (медленная), называется порогом коагуляции. Для осуществления быстрой коагуляции требуется такая концентрация электролита сб, после увеличения которой скорость коагуляции остается постоянной. Введение электролита в дисперсную систему снижает потенциальный барьер, который при быстрой коагуляции становится равным нулю.
В соответствии с теорией ДЛФО введение электролита в дисперсную систему вызывает сжатие двойного электрического слоя на поверхности частиц, вследствие чего они могут подойти друг к другу на расстояния, на которых преобладают силы притяжения. Уменьшение толщины двойного ионного слоя происходит как за счет уменьшения электрического потенциала в результате специфической адсорбции ионов введенного электролита на поверхности частиц, так и из-за ограничения диффузии противоинов в раствор в связи с увеличением ионной силы раствора. Оба эти фактора способствуют снижению потенциального барьера Umax. На рис. 4.4 представлены потенциальные кривые взаимодействия между частицами при различных концентрациях электролита. При малых концентрациях с<<ckp (рис.4.4, кривая 1) двойной слой на поверхности частицы имеет большую протяженность, следовательно, силы отталкивания имеют большой радиус действия. На потенциальной кривой имеется потенциальный барьер Umax. Cкорость коагуляции в системе, имеющей потенциальный барьер, определяется вероятностью столкновения частиц с кинетической энергией Е>Umax. Из кривых распределения частиц по кинетическим энергиям следует, что самые быстрые частицы имеют кинетическую энергию Е ≈ 15кТ (при среднем значении Е = кТ). Поэтому даже при величине потенциального барьера Umax>kT система может быть относительно устойчива, а потенциальный барьер Umax≥15кТ непреодолим практически для всех частиц системы. При такой величине потенциального барьера коагуляция идет с предельно малой скоростью и система является агрегативно устойчивой.
Повышение концентрации электролита не влияет на силы притяжения, которые определяются свойствами вещества дисперсной фазы, но уменьшает толщину двойного электрического слоя и радиус действия электростатических сил отталкивания. В связи с этим при некоторой концентрации электролита частицы могут подойти ближе друг к другу. Это приводит к уменьшению потенциального барьера и появлению вторичного энергетического минимума на больших расстояниях (рис. 4.4,кривая 2). Агрегативная устойчивость системы при таком виде потенциальной кривой зависит от величины потенциального барьера, препятствующему непосредственному контакту частиц, и кроме того от глубины вторичного минимума. При достаточно большой величине потенциального барьера (Umax>15kT) скорость коагуляции будет определяться вероятностью столкновения частиц, кинетическая энергия которых Е<Umin.II .Если это неравенство выполняется, то при сближении частицы фиксируются на некоторых расстояниях друг от друга через прослойку дисперсионной среды. Это так называемая дальняя агрегация, или коагуляция во вторичном минимуме.
Рис. 4.4. Потенциальные кривые взаимодействия частиц при различных концентрациях электролита: концентрация уменьшается от кривой 1
Д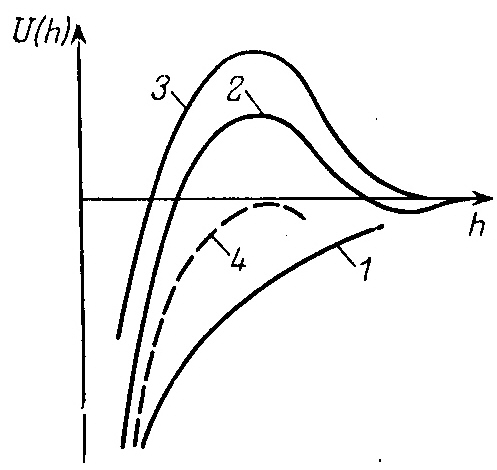 альнейшее
повышение концентрации электролита до
с >ckp
в конечном итоге приводит к исчезновению
потенциального барьера, электростатические
силы отталкивания на всех расстояниях
меньше сил притяжения (рис. 4.4, кривая
4), при этом любое столкновение частиц
дисперсной фазы заканчивается слипанием.
альнейшее
повышение концентрации электролита до
с >ckp
в конечном итоге приводит к исчезновению
потенциального барьера, электростатические
силы отталкивания на всех расстояниях
меньше сил притяжения (рис. 4.4, кривая
4), при этом любое столкновение частиц
дисперсной фазы заканчивается слипанием.
В зависимости от преоладающего механизма коагуляционных процессов различают нейтрализационную коагуляцию, когда потеря устойчивости происходит в результате разряжения коллоидных частиц и уменьшения их -потенциала и концентрационную коагуляцию.
Нейтрализационная коагуляция более характерна для систем с частицами, обладающими малым электрическим потенциалом. В этом случае особое значение имеет специфическая адсорбция ионов добавляемого электролита, имеющих заряд, одинаковый по знаку с зарядом противоиона двойного электрического слоя. Эти ионы, находясь в адсорбционном слое, резко снижают потенциал ( происходит нейтрализация -потенциала уже в адсорбционном слое). Специфичность адсорбции повышается с увеличением заряда адсорбируемого иона, поэтому вклад нейтрализационной коагуляции растет при переходе к электролитам с многовалентными ионами.
Концентрационная коагуляция обусловлена сжатием двойного электрического слоя в результате увеличения ионной силы раствора и уменьшения в связи с этим диффузионной составляющей взаимодействия противоионов с заряженной поверхностью. Этот вид коагуляции осуществляется при добавлении индифферентных электролитов, не способных к специфической адсорбции на поверхности коагулирующих частиц. Преобладающее влияние ионной силы дисперсионой среды характерно для систем с высокозаряженными частицами.
В теории ДЛФО порог коагуляции рассчитывают на основании предположения о том, что при с = сб потенциальная кривая имеет вид кривой, изображенной на рис.4.4, кривая 3. Критическая концентрация определяется решением системы уравнений, справедливой при h=h1 (максимум на потенциальной кривой):
|
(4.13) |
Решение системы (4.13) с учетом (2.4.) позволяет получить соотношение между потенциалом и толщиной двойного электрического слоя, величина которого отвечает порогу быстрой коагуляции:
|
(4.14) |
Значения константы В, характерной для данной системы, можно достигнуть, изменяя один из параметров двойного слоя с помощью электролитов. Если указанное соотношение больше константы В, то система агрегативно устойчива, если меньше - происходит коагуляция.щ
Учитывая выражение
для
![]() (2.4), из (4.14) получим уравнение зависимости
порога быстрой коагуляции от заряда
противоиона z
в области малых потенциалов:
(2.4), из (4.14) получим уравнение зависимости
порога быстрой коагуляции от заряда
противоиона z
в области малых потенциалов:
|
(4.15) |
В области больших потенциалов энергия взаимодействия между частицами практически не зависит от значения потенциала , поэтому условие устойчивости и коагуляции в таких системах определяется толщиной диффузной части слоя и критической концентрацией электролита:
|
(4.16) |
а зависимость порога быстрой коагуляции от заряда противоиона с учетом (2.4) выражается соотношением :
сб = const/z6 |
(4.17) |
Из соотношений (4.15) и (4.17) следует, что коагулирующее действие электролитов зависит от заряда противоионов, и тем сильнее, чем больше потенциал поверхности. Уравнения (4.16), (4.17) дают теоретическое обоснование правилу значности - сильной зависимости порога коагуляции от валентности иона, вызывающего коагуляцию. Для систем с высокозаряженными поверхностями порог быстрой коагуляции обратно пропорционален заряду противоиона в шестой степени (4.17). Значения порогов коагуляции, вызываемой электролитами с зарядами противоионов 1, 2 и 3, в соответствии с уравнением (4.17) относятся как
1:(1/2)6 : (1/3)6 = 1 : 1/64 : 1/729
По эмпирическому правилу значности, сформулированному Шульце-Гарди, значения порогов коагуляции для тех же противоионов находятся в соотношении
1 : 1/20 : 1/500
Несколько меньшая экспериментальная зависимость порога коагуляции от заряда иона, чем z6 , объясняется, по-видимому, увеличением специфической адсорбции с ростом заряда ионов.
Коагулирующая способность ионов с одинаковой валентностью зависит от их поляризуемости и гидратации. Так как поляризуемость возрастает, а степень гидратации уменьшается с увеличением размеров ионов, то при введении в коллоидную систему ионов с большим радиусом диффузный слой сжимается сильнее и порог коагуляции уменьшается. Например, пороги коагуляции уменьшаются в ряду катионов и анионов в следующем порядке:
Li+ > Na+ > K+ > Rb+ > Cs+
Cl- >Br- > NO3- > I-.
Рассмотренные выше закономерности коагуляции электролитами можно сформулировать в виде кратких правил электролитной коагуляции:
1) коагулирующим действием обладает любой электролит, в том числе и электролит-стабилизатор;
2) наименьшая концентрация электролита, при которой начинается коагуляция (медленная), называется порогом коагуляции;
3) коагулирующим является тот ион электролита, знак заряда которого совпадает со знаком заряда противоиона двойного электрического слоя;
4) коагулирующая сила иона растет с увеличением его заряда (чем больше заряд иона, тем меньше порог коагуляции);
5) в ряду ионов с одинаковым по величине зарядом коагулирующее действие тем больше, чем больше радиус иона.
4.5 ВЛИЯНИЕ СВОЙСТВ СИСТЕМЫ И ВНЕШНИХ УСЛОВИЙ НА АГРЕГАТИВНУЮ УСТОЙЧИВОСТЬ
Влияние дисперсности
Большинство дисперсных систем, как правило, полидисперсны. Поэтому при исследовании устойчивости таких систем следует учитывать этот фактор и анализировать результат столкновения частиц как одинакового, так и разного размера. Энергия молекулярного и электростатического взаимодействия частиц одинакового размера прямо пропорциональна радиусу частиц. Поэтому увеличение размера частиц влечет за собой увеличение потенциального барьера и глубины вторичного минимума. Основываясь на этом следствии из теории ДЛФО, можно заключить, что высокодисперсные системы (а <10-7 м) более склонны к ближней агрегации (с преодолением потенциального барьера), а грубодисперсные системы (суспензии, эмульсии) - к дальней (во вторичном минимуме). Скорость дальней коагуляции в грубодисперсных системах становится существенно ниже в присутсвии агрегативно устойчивых золей. В этом случае в результате коагуляции или гетерокоагуляции на поверхности крупных частиц образуется защитный слой из мелких, который экранирует молекулярные силы, действующие между крупными частицами, и тем самым способствует стабилизации системы.
Влияние концентрации дисперсной фазы
В концентрированных системах средние расстояния между частицами могут быть соизмеримы с радиусом действия поверхностных (электростатических и молекулярных) сил. Поэтому поведение каждой частицы будет зависеть от ее взаимодействия со всеми окружающими частицами.
Коллективное взаимодействие частиц рассмотрим на примере взаимодействия выделенной частицы с двумя соседними (рис. 4.5). Для построения потенциальной кривой коллективного взаимодействия необходимо просуммировать энергию в местах наложения потенциальных кривых взаимодействия выделенной частицы с каждой соседней частицей.
Как видно из рис.4.5, повышение концентрации дисперсной фазы приводит к уменьшению потенциального барьера, препятствующего слипанию частиц (рис. 4.5, б) и его исчезновению при некоторой концентрации (рис.4.5, в). Таким образом, повышение концентрации дисперсной фазы приводит к коагуляции даже в тех случаях, когда потенциальный барьер парного взаимодействия частиц значительно больше kT. Такую коагуляцию называют стесненной.
Влияние внешних силовых полей
В гетерогенных дисперсных системах под воздействием электрического поля на поверхности частиц возникают поляризационные заряды (в лиофобных золях происходит деформация мицеллы). Знаки зарядов противоположны направлению вектора поля - частицы приобретают свойства диполя. Между поляризованными частицами кроме электростатических и молекулярных сил действуют силы притяжения дипольной природы. Дипольные силы являются дальнодействующими, и поэтому на потенциальной кривой взаимодействия частиц в электрическом поле на больших расстояниях всегда имеется потенциальный минимум. Его глубина зависит от напряженности поля Е и увеличивается с ростом Е. При достаточной глубине энергетического минимума происходит коагуляция частиц, имеющая обратимый характер; при снятии электрического поля система восстанавливает первоначальную устойчивость. Энергия дипольного взаимодействия может стать больше потенциального барьера. В этом случае наблюдается необратимая коагуляция.
Контрольные вопросы
1. Назовите виды устойчивости дисперсных систем. В чем заключается различие между лиофильными и лиообными коллоидными системами?
2. Чем обусловлена агрегативная неустойчивость лиофобных дисперсных систем? Какие самопроизвольные процессы происходят в них?
3. Какой процесс называют коагуляцией? Чем заканчивается коагуляция? Как можно вызвать коагуляцию лиофобной дисперсной системы?
4. Какие факторы обеспечивают агрегативную устойчивость коллоидных систем?. Какие вещества используют в качестве стабилизаторов лиофобных диспрсных систем?
5. Что такое расклинивающее давление и каковы причины его возникновения?
6. Изложите основные положения теории устойчивости и коагуляции ДЛФО. Какие составляющие расклинивающего давления рассматривает эта теория?
7. Объясните различие между нейтрализационной и концентрационной коагуляцией лиофобных золей электролитами. Как влияет заряд коагулирующего иона на порог коагуляции?
8. Приведите примеры потенциальных кривых взаимодействия между частицами для дисперсных систем с различной степенью устойчивости.
