
- •Содержание
- •1. Характеристика дисперсных систем
- •1.1 Коллоидное состояние вещества
- •1.2 Растворы высокомолекулярных соединений
- •1.3 Классификация дисперсных систем
- •2. Электрические свойства дисперсных систем
- •2.1 Возникновение двойного электрического слоя
- •2.2 Строение двойного электрического слоя
- •2.4.Электрокинетические явления
- •3. Получение дисперсных систем
- •3.1 Метод диспергирования
- •3.2 Метод пептизации
- •3.3 Метод конденсации
- •3.4 Строение мицеллы
- •4. Устойчивость и коагуляция дисперсных систем
- •4.1 Факторы устойчивости дисперсных систем
- •4.2 Расклинивающее давление
- •4.3 Основные положения теории длфо
- •4.4 Закономерности коагуляции дисперсных систем электролитами
- •5. Лабораторные работы Работа 2.1 получение коллоидных растворов методом конденсации
- •Реакции восстановления
- •Реакции обмена
- •Реакции гидролиза
- •Работа 2.2 коагуляция лиозоля канифоли электролитами
- •Вариант 2 Исходные коллоидные растворы:
- •Вариант 3
3.4 Строение мицеллы
Получение коллоидных растворов методом химической конденсации сопровождается, как правило, образованием на поверхности твердых частиц двойного электрического слоя. Трудно растворимые вещества содержат в кристаллической решетке атомы (ионы), обладающие силами остаточных валентностей. Действие этих сил вызывает избирательное присоединение ионов из растворов. В качестве примера рассмотрим реакцию получения иодида серебра АgI при взаимодействии AgNO3 и KI в сильно разбавленных растворах:
KI + AgNO3 = KNO3 + AgI
K+ + I- + Ag+ + NO3 - = K+ + NO3 - + AgI.
Е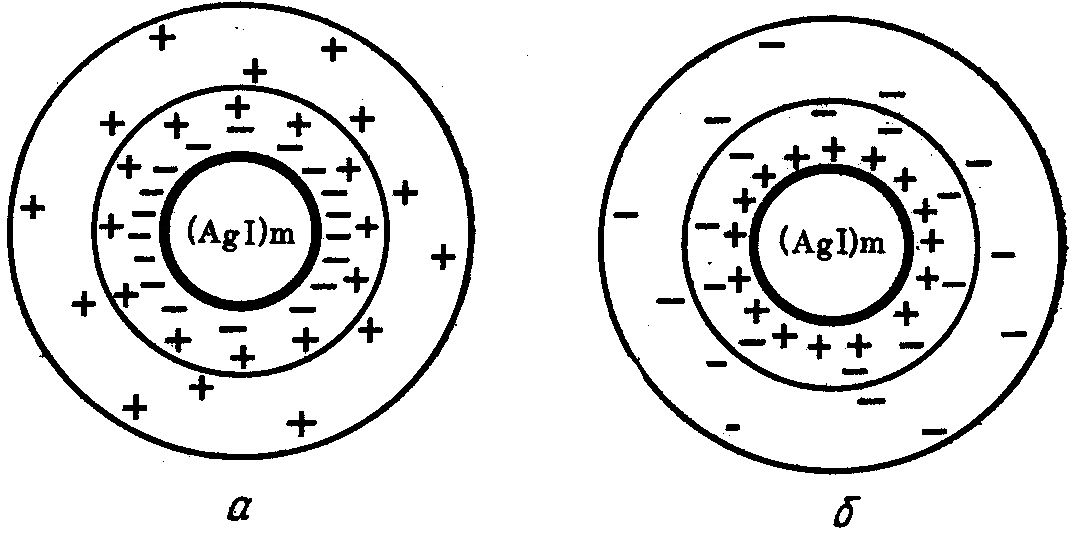 сли
к раствору KI
прибавлять по каплям раствор AgNO3,
то на поверхности твердой частицы иодида
серебра, состоящей из m
молекул AgI,
будут избирательно адсорбироваться
только ионы I-
(но не К+),
находящиеся в избытке в системе, и
частица заряжается отрицательно
(рис.3.1, a).
сли
к раствору KI
прибавлять по каплям раствор AgNO3,
то на поверхности твердой частицы иодида
серебра, состоящей из m
молекул AgI,
будут избирательно адсорбироваться
только ионы I-
(но не К+),
находящиеся в избытке в системе, и
частица заряжается отрицательно
(рис.3.1, a).
Рис. 3.1. Схема мицеллы AgI^
а - с отрицательно заряженными частицами;
б - с положительно заряженными частицами
В роли противоионов выступают ионы К+, часть которых находится в плотном слое, а другая часть - в диффузном слое.
Когда же порядок прибавления растворов обратный (в избытке ионы Ag+ и NO3 -), твердая фаза благодаря адсорбции катионов Ag+ получит положительный заряд (рис.3.1, б). И в этом случае заряд потенциалопределяющих ионов Аg+ компенсируется противоионами NO3-, система в целом электронейтральна. Таким образом, частица дисперсной фазы коллоидной системы представляет собой новообразование, состоящее из полимолекулярного агрегата коллоидных размеров и двойного электрического слоя. Такое новообразование получило название мицелла. Руководствуясь современной теорией строения двойного электрического слоя, запишем формулу мицеллы коллоидного раствора иодида серебра AgI, схема которой представлена ра рис. 3.1, а
|
(3.6) |
где m - количество молекул, составляющих частицу дисперсной фазы;
n - количество потенциалопределяющих ионов I-;
(n - x) - количество противоионов в плотной части двойного электрического слоя ;
х - количество противоионов в диффузной части.
В соответствии с этим рассматривают и строение мицеллы. Внутреннюю часть мицеллы составляет агрегат вещества фазы, в формуле мицеллы (3.6) агрегат заключен в квадратные скобки. На поверхности агрегата расположены потенциалопределяющие ионы. Агрегат [mAgI] вместе с потенциалопределяющими ионами nI- составляет ядро мицеллы [mAgI]nI-. Ядро с противоионами плотной части (n-x)К+ двойного ионного слоя образуют гранулу (гранулу еще называют коллоидной частицей). В формуле мицеллы гранула помещена в фигурные скобки. Заряд ядра в грануле компенсирован противоионами частично, поэтому гранула заряжена. Гранулу окружают противоионы диффузной части, которые полностью компенсируют заряд потенциалопределяющих ионов, следовательно, мицелла в целом нейтральна. Распределение зарядов и потенциала в мицелле аналогично тому же в двойном электрическом слое (рис. 2.1). В непосредственной близости к отрицательно заряженной ионами I- поверхности ядра, на расстоянии, равному среднему ионному радиусу, расположен слой противоионов (n - x)К+. Эти ионы входят в адсорбционный слой толщиной . В обычных условиях они неподвижны и перемещаются вместе с агрегатом. Вправо от адсорбционного слоя ионов - в окружающем растворе (дисперсионной среде) - диффузно распределен остаточный заряд, уменьшающийся до нуля по мере удаления от поверхности фазы вглубь раствора. Это диффузная часть слоя, образованная подвижными противоионами (хК+). Граница между адсорбционной и диффузной частями, т.е. граница между гранулой и средой (линия АВ), характеризуется электрокинетическим потенциалом ζ.
3.5 ПРИМЕРЫ ПОЛУЧЕНИЯ КОЛЛОИДНЫХ СИСТЕМ МЕТОДОМ ХИМИЧЕСКОЙ КОНДЕНСАЦИИ
При взаимодействии газообразных аммиака и хлористого водорода образуется аэрозоль (дым) твердого хлорида аммония — реакция присоединения:
NH3 + HC1 → NH4C1(тв)
Гидрозоль серы получается при окислении различных соединений серы. Например, при подкислении раствора гипосульфита натрия серной кислотой образуется свободная тиосерная кислота, которая разлагается, выделяя серу:
3Na2S2O3 + H2SO4 → 4S + 3Na2SO4 + H2O
В очень разбавленных растворах тиосульфата и кислоты возникновение зародышей становится заметным только через час. И лишь, когда концентрация среды достигнет 5 10-6 моль/л, мгновенно накапливается около 2 106 зародышей в 1 мл раствора. Эти зародыши быстро растут до размера 2 мкм и сохраняют его достаточно долго. Таким образом, при правильном подборе условий сера не выделяется в осадок, а образуется ее гидрозоль.
Гидрозоль серы можно получить окислительно-восстановительной реакцией, например окислением сероводорода (сероводородной воды) кислородом воздуха:
2H2S + О2 → 2S + 2Н2О
или сернистым газом в водной среде:
2H2S + SO2 → 3S + 2Н2О
Пары фосфора, окисляясь на воздухе, образуют аэрозоль пятиокиси фосфора:
4Р (пар) +5О2 (газ) → 2Р2О5 (тв)
Реакцией восстановления можно получить коллоидные растворы многих металлов (в первую очередь благородных) и неметаллов (селен, теллур). В качестве восстановителей используют перекись водорода, гидразин, формальдегид, аскорбиновую кислоту и др. Для иллюстрации приведем схему получения гидрозоля золота из золотохлористоводородной кислоты путем восстановления в щелочном растворе хлорида золота (III). При взаимодействии золотохлористоводородной кислоты с карбонатом калия получается аурат калия:
2НАиСl4 + 5К2СО3 → 2КАиО2 + 5СО2 + 8КС1 + Н2О
При добавлении формальдегида идет восстановление металлического золота:
2КАиО2 + ЗНСНО + К2СО3 → 2Аи + ЗНСООК + КНСО3 + Н2О
Стабилизатором служит аурат калия. Частицы золота заряжены отрицательно, так как они адсорбируют анионы золотой кислоты; образуется мицелла следующего состава:
|
|
Положительно заряженный золь можно получить гидролизом солей, образованных слабым основанием тяжелого металла и сильной кислотой. Так, при нагревании разбавленного раствора хлорида железа (III) образуется гидрозоль гидроокиси железа (III):
FeCl3 + ЗН2О → Fe(OH)3 + 3HCI
Вследствие обратимости реакции гидролиза в системе присутствуют ионы FeO+ , Fe3+ и ионы C l- и состав и формулу мицеллы можно представить следующей схемой:
|
|
Пары тетрахлорида кремния «дымят» на воздухе вследствие гидролиза парами воды и образования аэрозоля двуокиси кремния, что можно схематически представить так:
SiCl4 (пар) +2Н2О (пар) → SiO2 (тв) + 4НС1 (газ)
Очень устойчивый гидрозоль трехсернистого мышьяка ярко-желтого цвета получают с помощью реакции обмена:
As2O3 + 3H2S → As2S3 + ЗН2О
Вследствие
диссоциации H2S
![]() HS-+H+
и HS-
H+
+ S2-
в растворе имеются гидросульфид-ионы
HS-
и сульфид-ионы S2-
, которые
адсорбируются труднорастворимой
частицей, сообщая ей отрицательный
заряд. Формула мицеллы трехсернистого
мышьяка записывается следующим образом:
HS-+H+
и HS-
H+
+ S2-
в растворе имеются гидросульфид-ионы
HS-
и сульфид-ионы S2-
, которые
адсорбируются труднорастворимой
частицей, сообщая ей отрицательный
заряд. Формула мицеллы трехсернистого
мышьяка записывается следующим образом:
|
|
При получении гидрозоля иодида серебра AgI стабилизатором являетсялюбой участник реакции, взятый в избытке:
КI + AgNO3 → Agl(тв) + KNO3
Если концентрация KI больше эквивалентной концентрации AgNO3, получается золь с отрицательно заряженными частицами, в противном случае гранула мицеллы заряжена положительно (рис. 3.1). При смешивании реагирующих веществ в строго эквивалентном отношении по уравнению реакции коллоидный раствор не образуется. В этом случае существенное значение имеет концентрация реагирующих веществ: при низких концентрациях исходных веществ получаются золи, при больших концентрациях - осадки, при очень больших концентрациях - гель.
Контрольные вопросы
1. Каковы пути синтеза дисперсных систем? Приведите примеры получения золя методом диспергирования и методом конденсации.
2. В чем заключается эффект понижения прочности (эффект Ребиндера) при диспергировании.
3. Объясните строение мицеллы. Напишите формулы мицелл золя с отрицательно и положительно заряженными частицами.
4. Что является условием образования новой фазы в процессе конденсации?
5. Как можно регулировать размеры частиц лиофобных дисперсных систем, получаемых методом конденсации?

 или
или