
- •1. Реакции замещения.
- •2. Реакции отщепления (дегидрирование)
- •3. Реакции перегруппировки (изомеризация)
- •5. Реакции разложения
- •5. Реакции полимеризации:
- •1. Гидрирование
- •2. Галогенирование
- •3. Гидрогалогенирование
- •5. Реакции полимеризации
- •1. Горение
- •2. Неполное окисление
- •1. Взаимодействие со щелочными и щелочноземельными металлами (Li, Na, k, Ca, Ba, Sr)
- •2.Взаимодействие с галогенводородными кислотами
- •1. Дегидратация (отщепление воды)
- •2. Дегидрирование
- •1. Горение (полное окисление)
- •2. Неполное окисление
- •1. Окисление спиртов дихроматом (Na2Cr2o7) или перманганатом (кMnО4)
- •2. Окисление спиртов оксидом меди (II)
1. Горение (полное окисление)
Спирты горят на воздухе с выделением большого количества тепла. С увеличением массы углеводородного радикала – пламя становится всё более коптящим.
![]()
При сгорании спиртов выделяется большое количество тепла:
![]()
Благодаря высокой экзотермичности реакции горения этанола, он считается перспективным и экологически чистым заменителем бензинового топлива в двигателях внутреннего сгорания. В этом случае энергия химических связей переходит в тепловую энергию, а затем в механическую, что позволяет двигаться автомобилям. В лабораторной практике этанол применяется как горючее для «спиртовок».
2. Неполное окисление
1). В присутствии окислителей [O] – K2Cr2O7 или KMnO4 спирты окисляются до карбонильных соединений:
![]()
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.

При окислении вторичных спиртов образуются кетоны.

Например:


Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
Качественные реакции на спирты
1. Окисление спиртов дихроматом (Na2Cr2o7) или перманганатом (кMnО4)
Качественная реакция на первичные и вторичные спирты!
В кислой среде
Окисление Na2Cr2O7
Для первичных и вторичных одноатомных спиртов качественной реакцией является взаимодействие их с раствором дихромата натрия. Для повышения скорости реакции ее проводят при нагревании, для создания кислой среды добавляют серную кислоту.
Первичные спирты окисляются дихроматом натрия до альдегидов.
Растворы дихроматов имеют оранжевый цвет и содержат хром в степени окисления +6. В кислой среде они переходят в растворы солей хрома в степени окисления +3 и приобретают зеленый цвет.
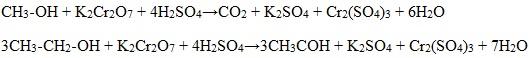
На изменении цвета соединений хрома также основана работа алкотестеров, когда пары спирта, содержащиеся в выдыхаемом водителем воздухе, восстанавливают дихромат в стеклянной трубочке.
Вторичные спирты окисляются дихроматом натрия до кетонов.
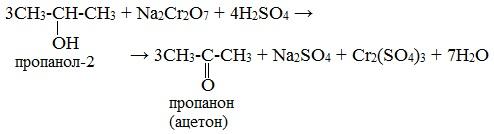
Третичные спирты в реакции с дихроматами не вступают.
Окисление KМnO4
Т.к. перманганат калия в кислой среде более сильный окислитель, чем дихромат, то окисление спирта не останавливается на стадии альдегида и продолжается дальше до карбоновой кислоты.

Раствор перманганата калия содержит марганец в степени окисления +7 и имеет розово-фиолетовый цвет. Если спирт взять в достаточном количестве, то произойдет обесцвечивание раствора. В кислой среде марганец перейдет в степень окисления +2.
Также как и дихроматом натрия, перманганатом калия вторичные спирты могут окисляться до кетонов. Далее возможна деструкция, т.е. разрушение органической молекулы и получение смеси веществ, которые не имеют практического применения.
В жёстких условиях с перманганатом калия третичные спирты окисляются с расщеплением связей С-С и образованием смеси веществ.
Метиловый спирт окисляется перманганатом калия до углекислого газа.

