
- •1. Реакции замещения.
- •2. Реакции отщепления (дегидрирование)
- •3. Реакции перегруппировки (изомеризация)
- •5. Реакции разложения
- •5. Реакции полимеризации:
- •1. Гидрирование
- •2. Галогенирование
- •3. Гидрогалогенирование
- •5. Реакции полимеризации
- •1. Горение
- •2. Неполное окисление
- •1. Взаимодействие со щелочными и щелочноземельными металлами (Li, Na, k, Ca, Ba, Sr)
- •2.Взаимодействие с галогенводородными кислотами
- •1. Дегидратация (отщепление воды)
- •2. Дегидрирование
- •1. Горение (полное окисление)
- •2. Неполное окисление
- •1. Окисление спиртов дихроматом (Na2Cr2o7) или перманганатом (кMnО4)
- •2. Окисление спиртов оксидом меди (II)
|
Реакция |
Описание |
Уравнение |
|
Гидрирование галогеналканов |
Побочным продуктом является кислота |
CH3Cl + H2 → CH4 + HCl |
|
Гидролиз карбида алюминия |
Метод получения метана |
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 |
|
Взаимодействие карбида алюминия с сильными кислотами |
В результате образуется неорганическая соль и метан |
– Al4C3 + H2Cl → CH4 + AlCl3; – Al4C3 + H2SO4 → CH4 + Al2(SO4)3 |
|
Реакция Дюма |
Сплавление солей карбоновых кислот со щелочами |
– CH3COONa + NaOH → Na2CO3 + CH4; – C2H5-COONa + NaOH → C2H6 + Na2CO3 |
|
Реакция Вюрца |
Взаимодействие натрия с галогенпроизводными алканов |
– 2CH3Cl + 2Na → C2H6 + 2NaCl; – CH3I + 2Na + C2H5I → C3H8 + 2NaI |
|
Гидрирование алкенов и алкинов |
Условия: высокая температура и присутствие катализатора (никеля) |
– C2H4 + H2 → C2H6; – C2H2 + 2H2 → C2H6 |
|
Реакция Кольбе (электролиз) |
Через раствор солей карбоновых кислот пропускается электрический ток. В результате на аноде протекает процесс окисления с образованием алканов |
2H2O + 2CH3COONa → H2 + 2NaHCO3 + C2H6 |
Получение алканов
Химические свойства алканов
Химические свойства алканов
1. Реакции замещения.
а) Галогенирование
при действии света - hν или нагревании (стадийно – замещение атомов водорода на галоген носит последовательный цепной характер. Большой вклад в разработку цепных реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов )
В реакции образуются вещества галогеналканы RГ или Сn H2n+1Г
(Г - это галогены F, Cl, Br, I)
CH4 + Cl2 hν → CH3Cl + HCl (1 стадия) ;
метан хлорметан
CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия);
дихлорметан
СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия);
трихлорметан
CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия).
тетрахлорметан
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:

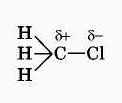
Электронная плотность связи С – Cl смещена к более электроотрицательному хлору, в результате на нём скапливается частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атом углерода в метильной группе ( - СН3) создаётся дефицит электронной плотности, поэтому он компенсирует свой заряд за счёт соседних атомов водорода, в результате связь С – Н становится менее прочной и атомы водорода легче замещаются на атомы хлора. При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайщего к заместителю:
CH3 – CH2 – Cl + Cl2 hν → CH3 – CHCl2 + HCl
хлорэтан 1,1 -дихлорэтан
Со фтором реакция идёт со взрывом.
С хлором и бромом требуется инициатор.
Иодирование происходит обратимо, поэтому требуется окислитель для удаления HI из рекции.
Внимание!
В реакциях замещения алканов легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных. Для хлорирования эта закономерность не соблюдается при T>400˚C.

б) Нитрование
(реакция М.И. Коновалова, он провёл её впервые в 1888 г)
CH4 + HNO3(раствор) t˚С → CH3NO2 + H2O
нитрометан
RNO2 или Сn H2n+1 NO2 (нитроалкан)
2. Реакции отщепления (дегидрирование)
а) CnH2n+2 t˚С, Ni или Pd → CnH2n + H2
б) При нагревании до 1500 С происходит образование ацетилена и водорода:
2CH4 1500°С → C2H2 + 3H2
3. Реакции перегруппировки (изомеризация)
н-алкан AlCl3, t°С → изоалкан
4. Реакции горения (горят светлым не коптящим пламенем)
CnH2n+2 + O2 t°С → nCO2 + (n+1)H2O
Помните! Смесь метана с воздухом и кислородом взрывоопасна
V(CH4) : V(O2) = 1: 2
V(CH4) : V(воздуха) = 1 : 10
5. Реакции разложения
а) Крекинг при температуре 700-1000°С разрываются (-С-С-) связи:
C10H22 t°С → C5H12 + C5H10
алкан алкен
б) Пиролиз при температуре 1000°С разрываются все связи,
продукты – С и Н2:
СH4 1000°С → C + 2H2
в) Конверсия метана с образованием синтез – газа (СО + Н2)
CH4 + H2O 800˚C, Ni → СО + 3Н2
Химические свойства алкенов
Для алкенов наиболее типичными являются реакции присоединения. В реакциях присоединения двойная связь выступает как донор электронов, поэтому для алкенов характерны реакции электрофильного присоединения.
Реакции присоединения
1. Гидрирование (гидрогенизация – взаимодействие с водородом):
CnH2n + H2 t, Ni → CnH2n+2
2. Галогенирование (взаимодействие с галогенами):
CnH2n + Г2 → СnH2nГ2
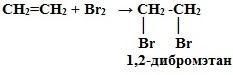
Это качественная реакция алкенов – бромная вода Br2 (бурая жидкость) обесцвечивается.
3. Гидрогалогенирование* (взаимодействие с галогенводородами):
![]()
4. Гидратация* (присоединение молекул воды):

CH2=CH2 + H2O t,H3PO4→ CH3-CH2-OH (этанол – этиловый спирт)
* Присоединение галогенводородов и воды к несимметричным алкенам происходит по правилу Марковникова В.В.
Присоединение водорода происходит к наиболее гидрированному атому углерода при двойной углерод-углеродной связи.
Исключения!!!
1) Если в алкене присутствует электроноакцепторный заместитель, т.е. группа, способная оттягивать на себя электронную плотность:
F3C ← CH=CH2 + H-Br → F3C - CH2 - CH2(Br) 1,1,1- трифтор-3-бромпропан
2) Присоединение в присутствии Н2О2 (эффект Хараша) или органической перекиси (R-O-O-R ):
СH3-CH=CH2 + H-Br Н2О2 → H3C - CH2 - CH2(Br)
