
Химческое равновесие
∆H=T∆S-условие термодинамического процесса
bB+dД=EL+mM
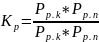
N2+3H2=2NH3
Принцип Л Шателье
Если на систему, находящуюся в состоянии равновесия оказывается, внешнее воздействие, то равновесие переходит в ту сторону, которая противодействует, чтобы уменьшить это воздействие
Лекция 26.10.12
Дисперсные системы-это гетерогенные системы, в которых одно вещество виде очень мелких частиц равномерно распределено в объёме другого, первое вещество – дисперсная фаза; другое – дисперсная среда.
1)классификация
2)растворы
3)свойства
4)Свойства растворов электролитов (ионные реакции обмена)
5)Гидролиз солей
По размерам частиц дисперсной фазы системы делятся на
1)грубодисперстные 10-3-10-5см
2)тонкодисперстные 10-5-10-7см(колоидные растворы)
Если размеры частиц < 10-7 то система становится гомогенной (растворы)
Растворы- много компонентные системы, состоящие из растворителя одного или нескольких и растворённого вещества.
Вода очень сильно влияет на свойства веществ, получить абсолютно сухое вещество задача практически невозможная.
Вода - полярный растворитель
В
А







С
О



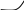
Процесс растворения вещества в воде – сложных физико-химический процесс
Молекулы вещества взаимодействуют с молекулами воды образуя гидраты
Растворы промежуточные системы между механическими смесями и химическими соединениями все растворы делятся на:
Неэлектролиты не пропускает электрический ток
Электролиты пропускает электрический ток
Разбавленные растворы неэлектролитов называют идеальными растворами
Не взаимодействуют с растворителем, распределяются в растворителе как газ в емкости.
Осмос-процесс диффузии частиц определённого сорта через полупроницаемую перегородку
закон Ван Гоффа:
полупроницаемая перегородка
раствор оказывает давление на полупроницаемую перегородку
P=CRT-закон Ван Гоффа
законы Рауля:
Над любой жидкостью находятся пары, которые оказывают давление на поверхность. Над раствором не летучего вещества находятся только пары воды или растворителя, давление этих паров становятся ниже.
P0-давление паров над растворителем
P-давление паров над раствором
∆P=P0-P
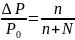
Давление паров влияет на t0

∆tзам=KCm
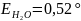
tзам=0-∆tзам
tкип=100+∆tкип
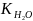 =1,86
=1,86
Свойства растворов электролитов
1)электролитическая диссоциация
2)РИО
Лекция 09.11.12
Гидролиз солей
Ионное произведение воды (водородный показатель)
Случаи гидролиза солей:
а) по катиону
Б) по аниону
В) по катиону и аниону
Г) отсутствие гидролиза
Д) полный необратимый гидролиз
H2O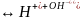
Гидролиз - процесс взаимодействия ионов соли с полярным действием воды, в результате которого образуется слабый электролит и изменяется ph среды
В процессе гидролиза катион соли или анион, или оба иона одновременно взаимодействуют с противоположными полюсами воды, образуя слабый электролит.
А)Если соль не образует с водой слабый электролит, то соль гидролизу не подвергается.
Гидролиз по катиону- процесс обратимый и много ступенчатый
I ступень
CuCl2+H2O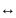 CuOHCl+HCl
CuOHCl+HCl
Cu2++2Cl-+H+OH- (CuOH)++H++2Cl-
Cu2++HOH CuOH++H+ pH<7
Cu (OH)2-слабое основание
HCl – сильная кислота
II ступень не идет (как правило, гидролиз останавливается на I ступени)
Соли образованные слабым основанием и сильной кислотой образуют основную соль или слабое основание. pH<7
Б) Гидролиз по аниону I ступень
H2S+H2o KHS+KOH (кислая соль)
2K++S-2+H+OH- (HS)-+OH-+2K+
S-2+HOH HS-+OH- pH>7
II ступень не идет
HOH – сильное основание
H2S – слабая кислота
Соли образованные сильным основанием и слабой кислотой подвергаются гидролизу по аниону образуя кислую соль и слабую кислоту. pH>7.
В) соли, образованные слабыми основаниями и слабой кислотой, подвергаются гидролизу по катиону и аниону, образуя 2 слабых электролита.
Среда слабо – кислая/ - щелочная
Г) соли, образованные сильной кислотой и сильным основанием гидролизу не подвергаются.
Некоторые соли образованные слабой кислотой и основанием подвергаются полному необратимому гидролизу, т.е. разлагается водой
Окислительно – восстановительные реакции
Понятие степени окисления.
Важнейшие окислители и восстановители
Составление реакций ОВР
ОВР – реакции, протекающие с изменением степени окисления некоторых атомов.
Степень окисления – условный заряд атома, вычисляется исходя из предположения, что молекула состоит только из ионов, каждый атом это ион.
H2SO4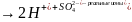
Атомы приобретают заряд, присоединяя или отдавая электроны, они стремятся к завершению внешней электронной оболочки.
В ОВР происходит переход электронов от одного атома к другому. Отдача – окисление.
Na0-1e→Na+ - отдача
Присоединение - восстановление
