
- •§ 1. Предмет технической термодинамики
- •Основные понятия и определения параметров состояния рабочих тел тепловых машин и установок тгСиВ.
- •1.3. Уравнение состояния рабочего тела
- •1.5. Первый закон термодинамики
- •Решение
- •1.6. Газовые смеси
- •1.7. Энтропия
- •1.8. Основные характеристики водяного пара и расчет параметров его состояния
- •1.9. Таблицы и диаграммы водяного пара
1.5. Первый закон термодинамики
Одним из основных законов природы является закон сохранения и превращения энергии. Впервые он был сформулирован в середине XVIII в. М. В. Ломоносовым.
Первый закон термодинамики является частным случаем закона сохранения и превращения энергии применительно к процессам взаимного превращения различных видов энергии, включая теплоту и работу. Он утверждает: энергия изолированной термодинамической системы остается неизменной, независимо от того, какие процессы в ней протекают.
Термодинамическим процессом принято называть совокупность последовательных состояний рабочего тела при его тепломеханическом взаимодействии с окружающей' средой. Для того чтобы к любому мгновенному состоянию рабочего тела в термодинамическом процессе можно было применить уравнение состояния, термодинамический процесс должен быть равновесным, т. е. он должен протекать при бесконечно малых разностях давлений и температур как в самом рабочем теле, так и между рабочим телом и окружающей средой. Для достижения равновесности процесс должен совершаться бесконечно медленно. Так как все реальные процессы происходят при конечных разностях давлений и температур, то все они неравновесны.
Обратимыми называются такие термодинамические процессы, которые могут быть проведены как в прямом направлении (например, расширение), так и в обратном (сжатие) через одну и ту же последовательность промежуточных состоянии с возвращением в исходное состояние как самого рабочего тела, так и окружающей среды. Обратимый процесс должен быть равновесным и происходить без трения и вихреобразования, для того чтобы работа не превращалась необратимо в теплоту. Поскольку в природе все реальные процессы неравновесны, то, следовательно, они и необратимы.
В зависимости от условий и характера протекания реальные процессы в той или иной степени приближаются к равновесным, причем эта степень приближения тем больше, чем медленнее протекают реальные процессы и чем меньше разность между параметрами рабочего тела и окружающей средой. Иными словами, обратимые процессы являются некоторым пределом, к которому в известной степени точности приближаются все необратимые реальные процессы.
- При рассмотрении термодинамического процесса в самом общем случае подводимая к рабочему телу теплота Q расходуется на изменение внутренней энергии Ли и совершение механической работы L, поэтому математическое выражение первого закона термодинамики для произвольного количества рабочего тела
Q = Δu + L, (1.29)
для 1 кг рабочего тела
q = Δи + l,
в дифференциальной форме
dq = du + dl.
Под внутренней энергией газа понимают сумму кинетической и потенциальной энергии атомов и молекул. Первая обусловлена скоростью движения и массой частиц, вторая — их взаимным расположением и силами взаимодействия между ними.
Внутренняя энергия реального газа является функцией состояния газа, т. 'е. функцией его параметров состояния, поэтому изменение ее в термодинамическом процессе не зависит от характера процесса, а определяется только начальными и конечными значениями параметров состояния, т. е.
![]()
С помощью уравнения состояния любой из параметров может быть выражен через два других, поэтому изменение внутренней энергии можно выразить функцией двух любых параметров состояния.
Внутренняя энергия идеального газа является функцией температуры газа и от давления не зависит:
![]()
Для 1 кг идеального газа изменение внутренней энергии
![]() (1.30)
(1.30)
где Cv — теплоемкость газа при v = const.
Для элементарного процесса
du = CvdT (1.31)
Механическая работа L газа зависит от характера ,процесса.
Рассмотрим работу произвольного количества газа М (кг) в цилиндре при перемещении поршня с площадью f на расстояние dS (рис. 1.1). Ввиду малости dS будем считать давление в цилиндре в процессе этого элементарного перемещения поршня постоянным и равным Р. Тогда абсолютная работа, совершаемая газом при расширении, т. е. работа перемещения поршня под действием силы F = f-P равна dL = FdS = = PfdS. Изменение объема dV = fdS, следовательно, dL = PdV. Графически элементарная работа dL (см. рис. 1.1) соответствует заштрихованной площадке.
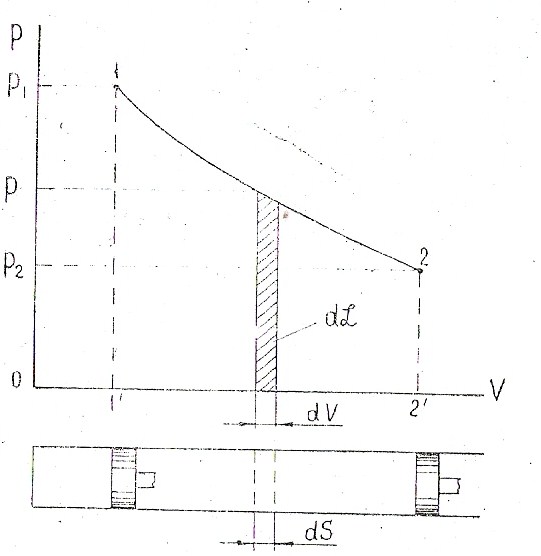
Рис. 1.1 Графический способ определения механической работы
Для 1 кг газа элементарная механическая работа газа
dl = Pdv. (1.32)
Если величина Р переменная, то полную работу на участке 1...2 процесса (см. рис. 1.1 ) определяем как
![]()
Работа L на участке 1....2 в PV координатах соответствует площади 1 — 2—2'—Г, расположенной под кривой, характеризую щей процесс.
Для 1 кг газа
![]() (1.33)
(1.33)
Необходимо учитывать, что полученные для определения механической работы формулы справедливы только для равновесных и обратимых процессов. Площадь, ограниченная кривой, характеризующей процесс в. РV-координатах, соответствует работе только обратимого процесса.
При необратимых процессах часть работы превращается в теплоту, поэтому работу необратимого процесса нельзя определить по приведенным формулам. Площадь, ограниченная кривой, характеризующей процесс в РV-координатах, не соответствует действительной работе.
учетом соотношения (1.32) для элементарной механической работы газа дифференциальное выражение первого закона термодинамики имеет вид:
dq = du.+ dl = c,dT + Pdv. (1.34)
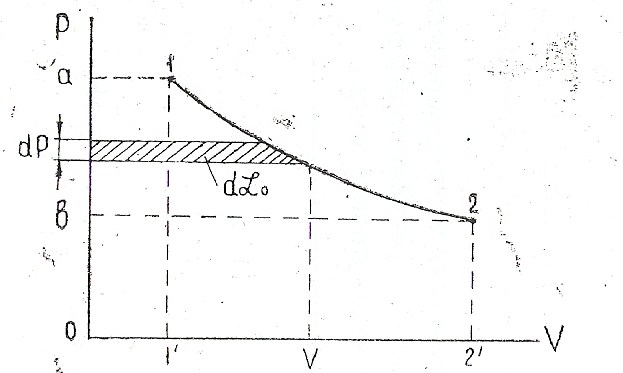
Рис. 1.2. Графический способ определения располагаемой работы.
Для конечного процесса с 1 кг газа
![]() (1.35)
(1.35)
Если учесть, что дифференциальное выражение работы Pdv может быть представлено в виде разности d(Pv)-vdP, то равенство (1.34) примет вид:
dq = du + d(Pv) - vdP = d(u + Pv) - vdP.
Сумма внутренней энергии и и произведение Pv представляют собой функцию состояния газа, называемую энтальпией:
![]() (1.36)
(1.36)
где Pv — работа проталкивания, численно равная работе, которую необходимо затратить, чтобы объем v «протолкнуть» с давлением Р. Таким образом, с учетом равенства (1.36) дифференциальное выражение первого закона термодинамики имеет вид:
dq = di - vdP = cpdT – υdP.
Это выражение в сравнении с равенством (1.34) называют второй формой дифференциального выражения первого закона термодинамики. Произведение vdP представляет собой некоторую элементарную работу, которая на рис. 1.2 представлена заштрихованной площадкой. Эту работу в отличие от механической работы газа называют располагаемой, или технической работой. Располагаемая работа конечного процесса 1...2 произвольной массы газа
L0
=−
Для 1 кг газа
l0=
−
Чтобы работа процесса с понижением давления была положительной (dP<0), принят знак минус.
Располагаемая, или техническая работа газа lо представляет собой работу, получаемую или затраченную при перенесении массы газа в область с более низким или с более высоким давлением. Она является результатом трех работ. На рис. 1.2 показан графический способ определения работы газа при понижении давления:
l0
= пл· а12b
= пл·all'0
+ пл·122'1' - пл·2b02'
= P1υ1
+
 υ
– P2υ2
=
P1υ1–
P2υ2
+
l.
υ
– P2υ2
=
P1υ1–
P2υ2
+
l.
Площадь a — 1 — 1' — 0 соответствует работе процесса наполнения цилиндра газом при давлении Р{. Работа, соответствующая площади 2 — b — 0 — 2', характеризует процесс выталкивания газа из цилиндра после совершения механической работы в процессе расширения. Рассмотренная совокупность процессов соответствует рабочему процессу газовой турбины, совершающей полезную работу при понижении давления газа.
Обратная последовательность процессов с наполнением цилиндра при низком давлении с последующими процессами сжатия и выталкивания из цилиндра сжатого газа при более высоком давлении соответствует рабочему процессу компрессорных машин. Таким образом, для конечного процесса второе выражение первого закона термодинамики принимает вид:
![]()
Выражение первого закона термодинамики, приведенное в виде соотношения (1.29), справедливо для процессов, в которых газ не имеет перемещения в пространстве. В случае движения газа, теплота, подводимая к нему, в самом общем случае будет затрачиваться на изменение его внутренней и кинетической энергии, а также на совершение работы против внешних сил. Поэтому первый закон термодинамики для одного килограмма движущегося газа можно записать в виде
![]()
где dlпр—работа против внешних сил в рассматриваемом процессе с подводом теплоты dq; d(ω2/2) — изменение кинетической энергии.
Работа проталкивания в элементарном процессе dlпр= d(Pv), а сумма du + d(Pv) = di, следовательно, dq = di + d(ω 2/2).
Для идеального газа
dq = CpdT + d(ω 2/2)
или
![]()
Для конечного процесса
![]()
Из равенства (1.38) следует, что при движении газа с постоянной скоростью, когда ω 2 = ω1, подводимая к газу теплота будет затрачиваться на увеличение его энтальпии, так как в этом случае q = i2 — i1.
В случае если течение газа происходит без подвода теплоты, q = 0, изменение кинетической энергии газа равно:
![]()
Задачи
Найти объемную теплоемкость кислорода при постоянном объеме и постоянном давлении, считая С = const.
Для двухатомных газов μCv = 20,93 кДж/(кмоль·К); μCp = 29,31 кДж/(кмоль·К). Следовательно, для кислорода (и любого двухатомного газа)
![]()
![]()
Вычислить среднюю теплоемкость с для воздуха при постоянном давлении в пределах 200...800°С, считая зависимость теплоемкости от температуры нелинейной (криволинейной).
Решение
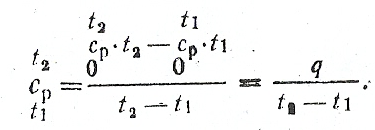
800
Из таблиц средняя теплоемкость ср =1,0710 кДж/(кг-К);
0
200
ср= 1,0115 кДж/(кг·К), тогда
0
200
ср=
 =1.091кДж/(кг·К).
=1.091кДж/(кг·К).
0
Решить предыдущую задачу, считая зависимость теплоемкости от температуры линейной.
