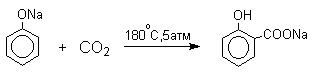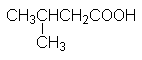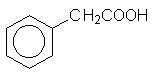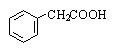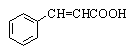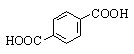КАРБОНОВЫЕ КИСЛОТЫ
План.
Классификация, номенклатура.
Методы получения насыщенных карбоновых кислот.
Строение, физические и химические свойства насыщенных монокарбоновых кислот.
Карбоновые кислоты являются производными углеводородов, в которых один или несколько атомов водорода замещены на карбоксильную группу.
Карбоновые кислоты можно подразделить на две основные группы:
Монокарбоновые кислоты (насыщенные, ненасыщенные, аренкарбоновые кислоты).
Ди- и поликарбоновые кислоты (ненасыщенные, насыщенные, арендикарбоновые и поликарбоновые кислоты).
Монокарбоновые кислоты
Классификация , изомерия и номенклатура
Монокарбоновые кислоты подразделяют в зависимости от природы углеводородного остатка.
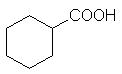
a) Насыщенные монокарбоновые кислоты (производные алканов и циклоалканов):
CnH2n+1COOH
, 
б) Ненасыщенные монокарбоновые кислоты (производные алкинов, алкенов, алкадиенов и других ненасыщенных углеводородов,
CnH2n-1COOH , CnH2n-3COOH и др.
в) Аренмонокарбоновые кислоты
ArCOOH, ArCH2COOH, ArCH=CHCOOH
Согласно номенклатуре IUPAC название карбоновых кислот образуют от названия родоначальных углеводородов с тем же числом атомов углерода, включая и атом карбоксильной группы, и окончания “–овая кислота”.
Нумерацию начинают от атома углерода карбоксильной группы. Многие карбоновые кислоты сохраняют тривиальные названия. Иногда название карбоновой кислоты образуют от названия углеводорода, содержащего карбоксильную группу в качестве заместителя. Примеры образования названий в карбоновых кислот приведены ниже
Формула |
Тривиальные названия |
Названия в системе IUPAC |
Названия с окончанием “карбоновая кислота” |
HCOOH |
Муравьиная кислота |
Метановая кислота |
|
CH3COOH |
Уксусная кислота |
Этановая кислота |
|
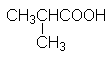
CH3CH2COOH |
Пропионовая кислота |
Пропановая кислота |
|
CH3CH2CH2COOH |
Масляная кислота |
Бутановая кислота |
|
|
Изомасляная кислота |
2-Метил-пропановая кислота |
|
CH3CH2CH2CH2COOH |
Валериановая кислота |
Пентановая кислота |
|
|
Изовалериановая кислота |
3-метилбу-тановая кислота |
|
(CH3)3C-COOH |
Пивалоновая кислота |
2,2-диметил-пропановая кислота |
2-метилпропан-карбоновая-2-кислота |
CH3(CH2)4COOH |
Капроновая кислота |
Гексановая кислота |
|
CH3(CH2)16COOH |
Стеариновая кислота |
Октадекановая кислота |
|
|
|
|
Циклогексанкарбо-новая кислота |
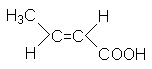
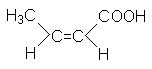
CH2=CH-COOH |
Акриловая кислота |
Пропеновая кислота |
Этиленкарбоновая кислота |
|
Метакриловая кислота |
2-Метилпропеновая кислота |
Пропенкарбоновая-2 кислота |
|
Кротоновая кислота |
транс-Бутен-2-овая кислота |
|
|
Изокротоновая кислота |
цис-Бутен-2-овая кислота |
|
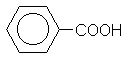
|
Бензойная кислота |
|
Бензолкарбоновая кислота |
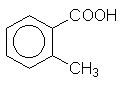
|
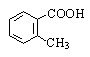
о-Толуиловая кислота |
|
o-Толуолкарбоновaя кислота |
|
Фенилуксусная кислота |
Фенилэтановая кислота |
|
|
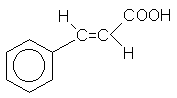
Коричная кислота |
транс-3-фенилпропеновая кислота |
|
Методы получения насыщенных монокарбоновых кислот
1. Окисление первичных спиртов и альдегидов.
В промышленном масштабе окисление ведут кислородом воздуха при катализе солями марганца или кобальта
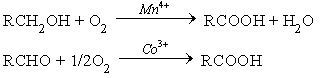
В лаборатории окисление осуществляют неорганическими окислителями: KMnO4 в кислой или нейтральной среде, K2Cr2O7 в кислой среде.
2. Окисление неразветвленных алкенов
![]()
Окислителями являются K2Cr2O7 в кислой среде или KMnO4 в кислой среде.
3. Окисление алкинов.
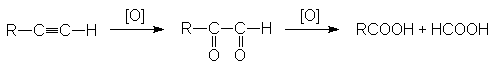
В качестве окислителей используют те же реагенты, что и при окислении алкинов.
4.Окисление алканов (промышленный метод)
RCH2CH2R' + 5/2O2 RCOOH + R'COOH + H2O
Окисление осуществляют при катализе реакции солями кобальта или марганца.
5. Гидролитические методы.
а) Кислотный гидролиз нитрилов
RC N + 2H2O + HX RCOOH + NH4X
б) Основной гидролиз нитрилов
RC N + H2O + NaOH RCOONa + NH3
в) Кислотный гидролиз амидов кислот
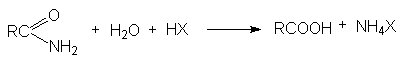
г) Основной гидролиз амидов кислот
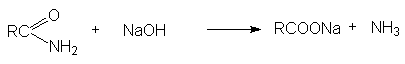
д) Кислотный гидролиз сложных эфиров
![]()
е) Основной гидролиз сложных эфиров
RCOOR' + NaOH RCOONa + R'OH
ж) Гидролиз ангидридов карбоновых кислот
(RCO)2O + H2O 2RCOOH
з) Гидролиз галогенангидридов карбоновых кислот
RCOHal + H2O RCOOH + HHal
и) Гидролиз соединений, содержащих трихлорметильную группу
RCCl3 + 2H2O RCOOH + 3HCl
Гидролиз осуществляет либо основанием, либо водой при катализе апротонными кислотами, например, FeCl3.
6. Металлоорганический синтез.

7. Реакции карбонилирования
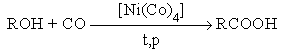
8. Гидрокарбоксилироание галогеналканов и алкенов.
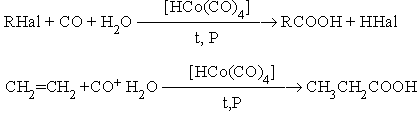
9. Синтез Арндта-Эйстерта
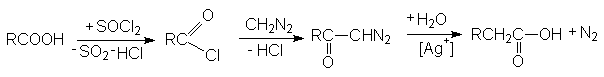
диазокетон
Эта реакция представляет собой удобный способ превращения карбоновой кислоты RCOOH в ее ближайший гомолог RCH2COOH.
Технически важную муравьиную и уксусную кислоты получают следующими способами.
Муравьиная кислота и ее эфиры:
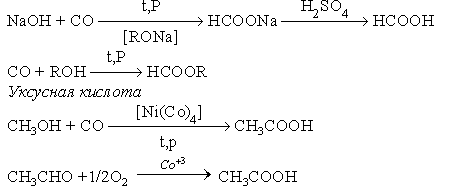
Физические свойства и строение
монокарбоновых кислот
Насыщенные монокарбоновые кислоты представляют собой бесцветные жидкие или кристаллические вещества с острым своеобразным запахом, высшие карбоновые кислоты (С15 – С18) имеют слабый запах стеарина. Они имеют весьма высокие температуры кипения, что свидетельствует о значительной межмолекулярной ассоциации следствие образования межмолекулярных водородных связей, причем образуются как циклические димеры, так и линейные олигомеры.

Электронографическое изучение карбоновых кислот показало, что в их молекуле имеются карбонильная и гидроксильная группа, при этом связь С = О длиннее, чем в кетонах, а связь С – О короче, чем в спиртах. Это свидетельствует о сопряжении неподеленной пары кислорода гидроксильной группы и орбиталей карбонильной группы
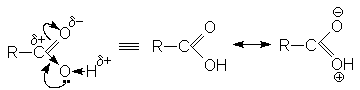
Проявляя +М – эффект, атом кислорода гидроксильной группы увеличивает полярность связей ОН, но в то же время в некоторой степени уменьшает положительный заряд на углеродном атоме по сравнению альдегидами и кетонами. Одновременно действует электроноакцепторный индуктивный эффект (-I) кислородных атомов.
Таким образом в карбоксильной группе имеется сильно поляризованный положительно атом водорода гидроксильной группы и углеродный атом которые являются нуклеофильными центрами. В то же время кислородный атом имеет нуклеофильный характер.
Химические свойства карбоновых кислот
Большинство реакций карбоновых кислот может быть отнесено к одному из четырех основных типов:
1.Реакции, сопровождающиеся разрывом О-Н-связей, например, кислотная диссоциация.
2.Реакции по карбонильному углероду, которые имеют нуклеофильный характер.
3.Реакции расщепления
4.Реакции по -углеродному атому алкильной группы.
Кислотность карбоновых кислот
По сравнению со спиртами карбоновые кислоты обладают более высокой кислотностью. При этом в растворе реализуется равновесие.
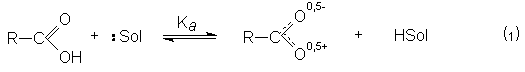
Способность к отдаче к протонам обусловлена двумя факторами: поляризацией связей О-Н в исходном состоянии и стабилизацией карбоксилат-аниона из-за деколализации отрицательного заряда в нем посредством резонанса.
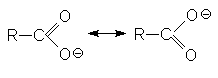
Кислотность карбоновых кислот характеризуется константой кислотности Ка или показателем рКа. Их значения обычно составляет приблизительно 10-5, что свидетельствует о слабости этих кислот. Присутствие в структуре радикала электроноакцепторных заместителей будет стабилизировать карбоксилат анион, что приведет к увеличению кислотности соответствующей ему кислоты. Например: рКа монохлоруксусной кислоты составляет 2,9 а уксусной – 4,8. По мере удаления электроноакцепторного заместителя от карбоксильной группы кислотность снижается, что связано с быстрым затуханием индуктивного эфекта: так рКа -хлорпропионовой кислоты составляет ~4,0. Наоборот, увеличение разветвления алкильного радикала приводит к снижению кислотности, так как при этом возрастает индуктивный эффект алкильной группы. На основе этих данных можно представить следующие ряды кислотности карбоновых кислот.
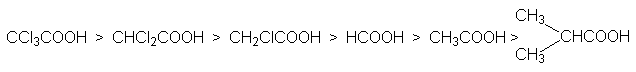
![]()
Кислотность карбоновых кислот проявляется в их взаимодействии с активными металлами и основаниями.
2RCOOH + 2Na 2RCOONa + H2
RCOOH + NaOH RCOONa + H2O
2RCOOH + Na2CO3 2RCOONa + H2O + CO2
Основность карбоновых кислот
В кислой среде (pH<3) диссоциация карбоновых кислот практически не происходит, так как равновесие (1) существенно смещено в левую сторону из-за избытка ионов HSol . В то же время в кислой среде осуществляется протонирование карбоновых кислот по основному карбонильному кислороду.
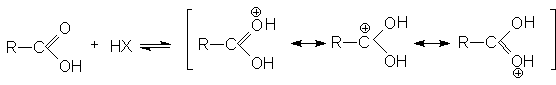
В протонированной форме оба кислородных атомов становятся одинаковыми:
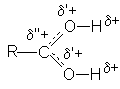
Несмотря на малую концентрацию протонированной формы присутствие небольших количеств сильных кислот исключительным образом влияет на реакционную способность карбоновых кислот: повышение положительного заряда на карбонильном углероде делает его восприимчивым к атаке нуклеофильными реагентами и открывает возможность для протекания многих реакций нуклеофильного замещения карбоновых кислот.
Реакции нуклеофильного замещения
1.Реакции этерификации
![]()
В механизме этой реакции ключевую роль играет протонирование карбоновой кислоты кислотой-катализатором.
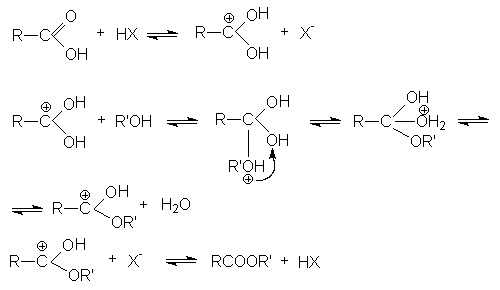
Реакция этерификации может осуществляться некаталитически, однако для этого требуется жесткие условия процесса.
2. Реакции с N-нуклеофилами (аммиаком, аминами, гидразином и др.).
N-нуклеофилы при взаимодействии с карбоновыми кислотами как правило образуют аммониевые соли (карбоксилаты) и только при повышенных температурах происходит присоединение N-нуклеофила к карбонильному углероду.

Механизм реакции согласуется с общепринятыми представлениями о механизме нуклеофильного присоединения азотистых оснований по карбонильной группе:

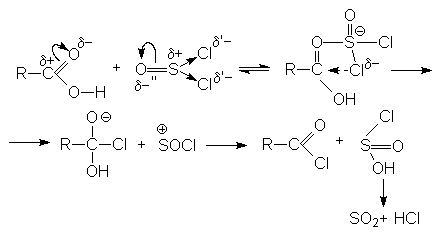
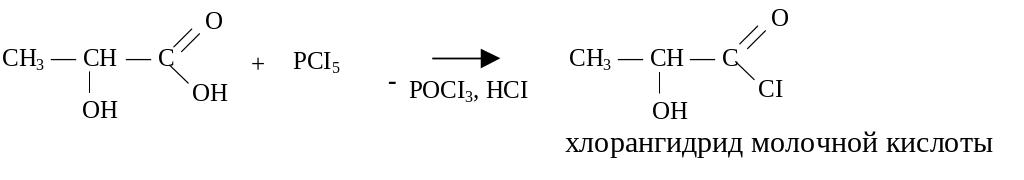
3. Взаимодействие с галогенангидридами хлорорганических кислот (PCl3, PCl5, PBr3, SOCl2 ).

Механизм реакции связан с концертной атакой электрофильного и нуклеофильного центров карбоновой кислоты молекулой галогенангидрида:
Реакции расщепления
1. Синтез Кольбе (см. подробно методы получения алканов).
![]()
2. Пиролиз карбоновых кислот.
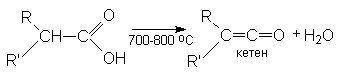
3. Реакция Хунсдиккера.
RCOOAg + Br2 RBr + CO2 + AgBr
В качестве объекта декарбоксилирования выступают серебряные или ртутные соли карбоновых кислот, а реагентами являются бром или йод.
Предполагают, что промежуточным продуктом этой реакции является гипогалогенит, который распадается на радикалы:
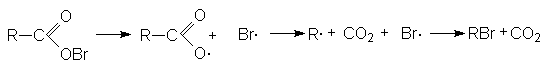
Эту реакцию можно осуществлять без выделения чистых солей ртути или серебра
2RCOOH + HgO + 2Br2 2RBr + HgBr2 + H2O + 2CO2
4. Пиролитическая кетонизация солей карбоновых кислот

Галогенирование по Гелю-Форгальду-Зелинскому
Эта реакция является примером взаимодействия по -углеродному атому по отношению к карбоксильной группе. Реакция бромирования протекает энергично и с хорошим выходом в присутствии небольших количеств фосфора.
![]()
Функция фосфора состоит в образовании трехбромистого фосфора, который, реагируя с кислотой, дает ацилбромид. Последний гораздо легче подвергается енолизации по сравнению с исходной кислотой. Бром по видимому реагирует с енолом ацилбромида так же как с енолами кетонов.
2P + 3Br2 2PBr3
RCH2COOH + PBr3 RCH2COBr + POBr + HBr
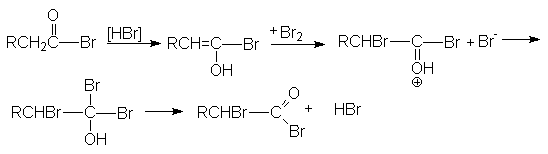
Регенерация исходного ацилбромида осуществляется за счет взаимодействия полученного монобромацилбромида с исходной кислотой.
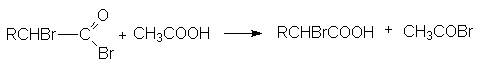
Хлор в присутствии следов фосфора реагирует аналогичным образом, но в целом менее селективно, поскольку конкурентно может происходить свободнорадикальное хлорирование во все положения углеродной цепи.
Взаимодействие с электрофильными реагентами
Атомы кислорода карбонильной группы недостаточно заряжены, чтобы быть объектом электрофильной атаки со стороны слабых и умеренных электрофильных реагентов. Для осуществления эффективной реакции электрофильного замещения по карбонильному углероду карбоксильной группы активируют, переводя ее карбоксилат – ионную форму. Тогда можно осуществить реакцию алкилирование, ацилирования и др.

Реакции восстановления карбоновых кислот
В целом карбоновые кислоты с трудом поддаются восстановлению как путем каталитического гидрирования, так и при действии натрия в спирте, но восстановление до первичных спиртов при действии литийалюминийгидрида или натрийборгидрида протекает достаточно энергично.
4RCOOH + 3LiAlH4 [(RCH2O)4Al]Li + 4H2 + 2LiAlO2
[(RCH2O)4Al]Li + 3H2O + HCl RCH2OH + Al(OH)3 + LiCl
Дикарбоновые кислоты.
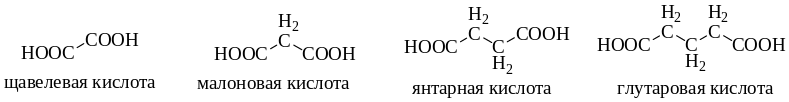
Соли щавелевой кислоты называются оксалатами. Некоторые трудно растворимые соли щавелевой кислоты могут образовывать камни в мочевыводящих путях. Янтарная кислота (соли — сукцинаты) в клетке подвергается ферментативному дегидрированию с образованием фумаровой кислоты, являющейся транс-изомером бутендиовой кислоты.


Гетерофункциональные соединения содержат в молекуле две и более различных функциональных групп. Эти соединения являются биологически важными соединениями, участниками многих процессов, происходящих в живых организмах, а также лекарственными препаратами.
К гетерофункциональным соединениям относятся аминоспирты, оксикислоты, аминокислоты, оксокислоты, витамины, гормоны, коферменты и др.
Аминоспирты содержат ОН и NH2 группы.
-

аминоэтанол (коламин), входит в состав фосфолипидов

холин, входит в состав фосфолипидов
Гидроксикислоты содержат ОН и СООН группы.
-

молочная кислота, соли — лактаты, образуется в процессе анаэробного гликолиза

яблочная кислота, соли — малаты, образуется в организме путем гидратации фумаровой кислоты
Оксокислоты (кетокислоты) содержат С=О и СООН группы.
-
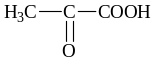
пировиноградная кислота, ПВК, соли — пируваты, образуется при окислении молочной кислоты, является промежуточным продуктом обмена углеводов

щавелевоуксусная кислота, ЩУК, соли — оксалоацетаты, кислота, участвует в процессах жизнедеятельности

α-кетоглутаровая кислота, участвует в процессах жизнедеятельности

β-кетомасляная кислота, является одним из кетоновых тел
ГИДРОКСИКИСЛОТЫ
Гидроксикислоты дают все реакции характерные для карбоксильной, гидроксильной групп и реакции, характерные только для гидроксикислот.
I. Свойства по карбоксильной группе.
Диссоциация. Гидроксикислоты, как правило, являются более сильными кислотами, чем обычные кислоты с тем же числом атомов углерода. Это связано с электроноакцепторным влиянием группы ОН, что приводит к повышению устойчивости образующегося карбоксилат-иона. Чем ближе ОН-группа располагается к карбоксильной группе, тем сильнее данная кислота.


Образование солей. Гидроксикислоты образуют соли со щелочами и солями более слабых кислот.

Реакции нуклеофильного замещения у sp2-гибридизованного атома углерода.
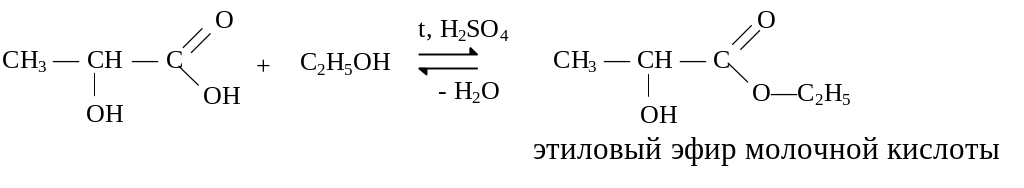
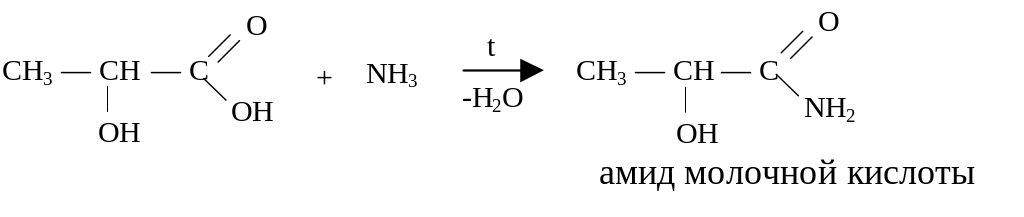
II. Свойства по гидроксильной группе. Образование солей.

Образование простых эфиров.

Образование сложных эфиров.

Важное биологическое значение имеют реакции окисления гидроксикислот, которые in vivo протекают при участии кофермента НАД+ и ферментов дегидрогеназ:


СПЕЦИФИЧЕСКИЕ РЕАКЦИИ a-, b-, g-ГИДРОКСИ- И АМИНОКИСЛОТ
a-Гидрокси- и аминокислоты при нагревании вступают в реакции межмолекулярного нуклеофильного замещения у sp2-гибридизованного атома углерода в карбоксильной группе.
При нагревании a-гидроксикислот образуется циклический сложный эфир — лактид, содержащий две сложноэфирные связи.

При нагревании a-аминокислот образуется циклический амид — дикетопиперазин, содержащий две амидные связи.

У b-гидрокси и b-аминокислот между двумя функциональными группами появляется СН-кислотный центр, что предопределяет протекание реакций внутримолекулярного элиминирования воды или, соответственно, аммиака.

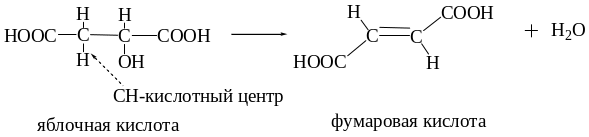
Яблочную кислота можно рассматривать и как a-, и как b-гидроксикислоту. Как b-гидроксикислота она подвергается внутримолекулярной дегидратации с образованием фумаровой кислоты. Реакция протекает ферментативно.
g -Гидрокси
и g-аминокислоты,
как кислоты с более удаленным расположением
функциональных групп, при нагревании
претерпевают дегидратацию за счет
идущей внутримолекулярно реакции SN
между карбоксильной группой и нуклеофилом
(OH-
или NH2-группой).
Из гидроксикислот при этом получаются
сложные внутренние циклические эфиры
— лактоны,
из аминокислот — внутренние циклические
амиды — лактамы.
-Гидрокси
и g-аминокислоты,
как кислоты с более удаленным расположением
функциональных групп, при нагревании
претерпевают дегидратацию за счет
идущей внутримолекулярно реакции SN
между карбоксильной группой и нуклеофилом
(OH-
или NH2-группой).
Из гидроксикислот при этом получаются
сложные внутренние циклические эфиры
— лактоны,
из аминокислот — внутренние циклические
амиды — лактамы.
П родукты
реакций межмолекулярного и
внутримолекулярного взаимодействий,
сохраняя свойства сложных эфиров или
амидов, способны к гидролизу с образованием
исходных соединений.
родукты
реакций межмолекулярного и
внутримолекулярного взаимодействий,
сохраняя свойства сложных эфиров или
амидов, способны к гидролизу с образованием
исходных соединений.
Особое свойство a-гидроксикислот заключается в их легкой способности разлагаться при нагревании в присутствии минеральных кислот с образованием карбонильных соединений и муравьиной кислоты.

ЛИМОННАЯ КИСЛОТА
Л имонная
(3-гидрокси-3-карбоксипентандио-вая)
кислота в больших количествах содержится
в плодах цитрусовых растений, а также
винограде, крыжовнике. Соли лимонной
кислоты называют цитратами и
используют для консервирования
и
хранения донорской крови (цитратная
кровь).
имонная
(3-гидрокси-3-карбоксипентандио-вая)
кислота в больших количествах содержится
в плодах цитрусовых растений, а также
винограде, крыжовнике. Соли лимонной
кислоты называют цитратами и
используют для консервирования
и
хранения донорской крови (цитратная
кровь).
Биосинтез лимонной кислоты происходит при взаимодействии щавелевоуксусной кислоты и ацетилкофермента А (первая стадия цикла трикарбоновых кислот). Реакция протекает по механизму АN и является реакцией альдольной конденсации.

При последующей дегидратации лимонной кислоты как b-гидроксикарбоновой кислоты получается цис-аконитовая кислота, которая далее гидратируется с образованием изолимонной кислоты по механизму АЕ.

Разложение лимонной кислоты при нагревании в присутствии серной кислоты происходит по типу разложения a-гидроксикарбоновых кислот.
|
|
ОКСОКИСЛОТЫ
Оксокислотами называют гетерофункциональные соединения, содержащие в молекуле одновременно карбоксильную и кетонную (или альдегидную) группы. В соответствии с этим различают кетонокислоты и альдегидокислоты.
Простейшим представителем альдегидокислот является глиоксиловая кислота НООС–СНО. Она содержится в недозрелых фруктах, но по мере созревания ее количество уменьшается. Глиоксиловая кислота обычно существует в виде гидрата НООС–СН(ОН)2.
Как гетерофункциональные соединения кетонокислоты проявляют свойства карбоновых кислот (реакции SN и кетонов (реакции AN), а также особые свойства.
Особые свойства. Пировиноградная кислота легко декарбоксилируется при нагревании с разбавленной Н2SO4.
|
|
|
In vivo эта реакция протекает в присутствии фермента декарбоксилазы и соответствующего кофермента. Образующийся ацетальдегид далее окисляется в ацетилкоэнзим А.

Пировиноградная кислота является одним из промежуточных продуктов молочнокислого и спиртового брожения углеводов.
Реакции переаминирования (трансаминирования) заключаются в обмене функциональными группами между кетокислотой и аминокислотой, при этом сохраняется углеродный скелет. При переаминировании α-кетонокислот образуются соответствующие α-аминокислоты.

КЕТОНОВЫЕ ТЕЛА
Кетоновые или ацетоновые тела образуются in vivo в процессе метаболизма высших жирных кислот. Процесс образования кетоновых тел активируется при сахарном диабете и голодании.

ТАУТОМЕРИЯ
Таутомерия — вид динамической изомерии, при которой изомеры могут переходить друг в друга, находясь одновременно в растворе в состоянии подвижного термодинамического равновесия. Такие соединения могут прореагировать полностью как в одной, так и в другой форме. Таутомерия расширяет реакционную способность природных соединений. В таутомерных формах в растворе существуют моносахариды, пептиды, пуриновые и пиримидиновые основания, другие соединения.
Большое теоретическое значение в связи с вопросами таутомерии и двойственной реакционной способности имеет ацетоуксусный эфир (этиловый эфир ацетоуксусной кислоты). В соответствии со строением у ацетоуксусного эфира (вещества, имеющего кетонную группу), протекают реакции нуклеофильного присоединения (AN). Однако при взаимодействии с натрием, гидроксидом натрия или при ацилировании в определенных условиях образуются производные b-гидроксикротоновой кислоты, т. е. соединения с енольной группой.
С пециальные
исследования показали, что ацетоуксусный
эфир находится в растворе в виде двух
форм: кето и енольной, находящихся
в термодинамическом равновесии. Атом
водорода метиленовой группы, находящейся
между двумя карбонильными группами,
обладает подвижностью, поэтому протон
С–Н кислотного центра может присоединиться
к основному центру кислорода
карбонильной группы.
пециальные
исследования показали, что ацетоуксусный
эфир находится в растворе в виде двух
форм: кето и енольной, находящихся
в термодинамическом равновесии. Атом
водорода метиленовой группы, находящейся
между двумя карбонильными группами,
обладает подвижностью, поэтому протон
С–Н кислотного центра может присоединиться
к основному центру кислорода
карбонильной группы.
Х арактерные
реакции на енольный фрагмент. Ацетоуксусный
эфир как енол дает с хлоридом железа
(III) характерное фиолетовое
окрашивание. Если к этому окрашенному
раствору прибавить по каплям бром, то
енольный таутомер, присоединяя бром по
двойной связи, переходит
в
бромпроизводное, и окраска исчезает.
Однако через некоторое время окраска
вновь появляется, так как нарушенное
равновесие восстанавливается, и кетонный
таутомер частично переходит в енольную
форму. Опыт можно повторить несколько
раз,
пока все взятое количество
ацетоуксусного эфира не прореагирует
с бромом.
арактерные
реакции на енольный фрагмент. Ацетоуксусный
эфир как енол дает с хлоридом железа
(III) характерное фиолетовое
окрашивание. Если к этому окрашенному
раствору прибавить по каплям бром, то
енольный таутомер, присоединяя бром по
двойной связи, переходит
в
бромпроизводное, и окраска исчезает.
Однако через некоторое время окраска
вновь появляется, так как нарушенное
равновесие восстанавливается, и кетонный
таутомер частично переходит в енольную
форму. Опыт можно повторить несколько
раз,
пока все взятое количество
ацетоуксусного эфира не прореагирует
с бромом.

Кето-енольной таутомерией обладают такие биологически важные соединения как пировиноградная кислота и щавелевоуксусная кислота.
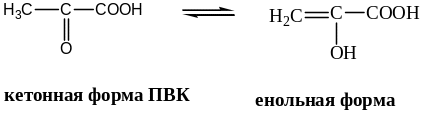
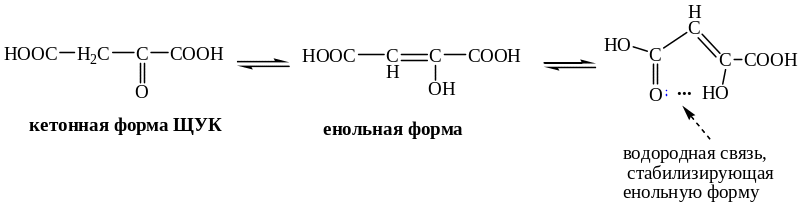
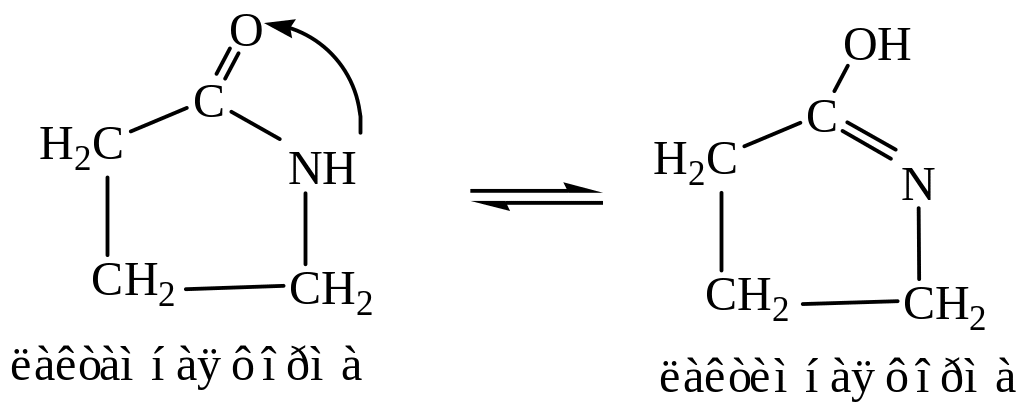
Существуют и другие виды таутомерии. Например, лактим-лактамная таутомерия. Лактим-лактамная таутомерия имеет важное значение для образования водородных связей пуриновыми и пиримидиновыми основаниями в нуклеиновых кислотах.
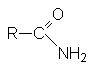
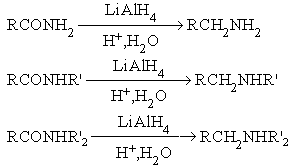
АМИДЫ КАРБОНОВЫХ КИСЛОТ
Эти соединения следует рассматривать как результат замещения гидрокси-группы в карбоновой кислоте на амино-группу
Методы получения амидов:
Ацилирование аммиака и аминов.
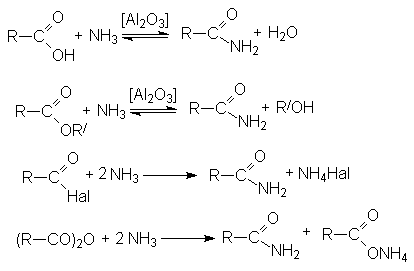
Дегидратация аммониевых солей карбоновых кислот
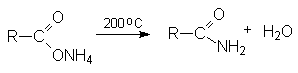
Гидролиз нитрилов карбоновых кислот

Перегруппировка оксимов кетонов по Бекману
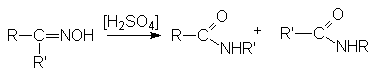
Обычно к атому азота мигрирует та группа, которая находится в транс-положении к ОН-группе.
Механизм перегруппировки Бекмана:
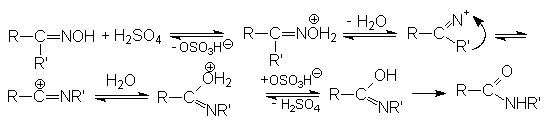
Синтез лактамов - циклических амидов.
Перегруппировка циклических амидов – лактамов
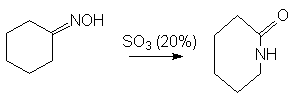
Реакция Байера-Виллигера
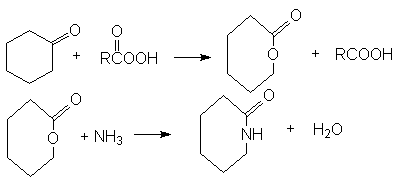
Циклизация аминокислот (n 3)
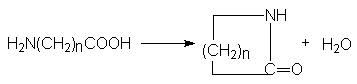
Физические свойства амидов. Строение амидной группы.
Амиды представляют собой бесцветные кристаллические вещества или жидкости, растворяющиеся в органических растворителях. Амиды, в молекулах которых имеются связи N-H, ассоциированы вследствие образования межмолекулярных водородных связей и имеют более высокие температуры кипения.
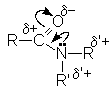
В молекулах амидов имеет место значительное сопряжение неподеленной парой электронов азота и -электронной системой двойной связи С=О. Это приводит к образованию дополнительной поляризации связей в амидной группе и наличие электрофильных реакционных центров на ацильном и алкильных углеродных атомах и отрицательного - на карбонильном кислороде.
Химические свойства амидов.
Реакции нуклеофильного замещения.
Примером может служить гидролиз. В нейтральной среде гидролиз протекает медленно. Поэтому реакцию ведут в присутствии минеральной кислоты либо основания, которые не только ускоряют ее, но и участвуют как реагенты.

Активация молекулы амида кислотой связана с ее протонированием и увеличением положительного заряда на карбонильном углероде, который становится более восприимчивым к последующей нуклеофильной атаке:
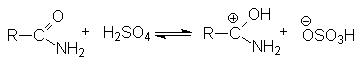
В случае щелочного гидролиза в качестве нуклеофила вместо воды выступает более реакционно способный гидроксил-анион, который эффективно осуществляет нуклеофильную атаку на кaрбонильный углерод:
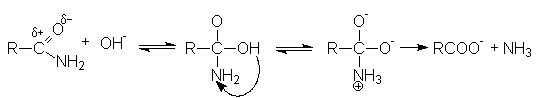
Реакция восстановления.
Реакция дегидратации.
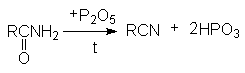
Расщепление по Гофману.
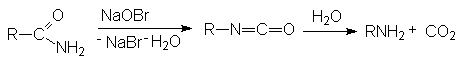
Механизм реакции
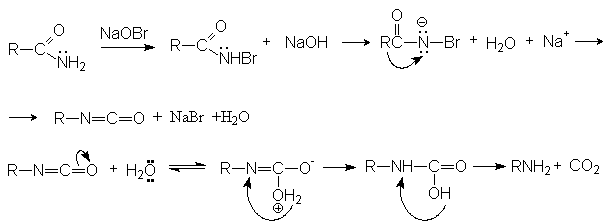
Перегруппировка Курциуса характерна для азидов карбоновых кислот, которые ведут себя подобно амидам в расщеплении по Гофману.
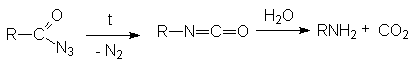
Взаимодействие формамидов с реактивом Гриньяра (реакция Буво)
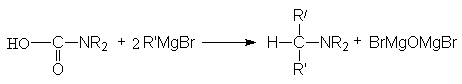
Продуктами этой реакции являются альдeгид и третичный амин.
НИТРИЛЫ КАРБОНОВЫХ КИСЛОТ
Общая формула нитрилов R-C N или CnH2n+1CN.
Методы получения нитрилов.
Дегидратация амидов карбоновых кислот с помощью водоотнимающих агентов.
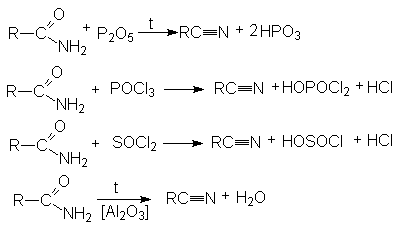
На практике в
последнем случае пропускают над
катализатором смесь карбоновой кислоты
с аммиаком. В этом процессе совмещается
образование амида и его дегидратация.
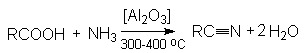
Нуклеофильное замещение галогена в галогеналканах на циaнид-анион.
![]()
Дегидратация альдоксимов.
![]()
Механизм реакции:
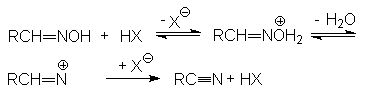
Химические свойства нитрилов.
Циано-группа характеризуется высокой степенью поляризации, следствием которой является образование частичного положительного заряда на углероде и отрицательного заряда – на азоте
![]()
Это обусловливает, с одной стороны, восприимчивость углеродного центра к нуклеофильной атаке, с другой – основность атома азота.
Реакции нуклеофильного присоединения.
Нитрилы легко реагируют с сильными анионными нуклеофильными реагентами (карбанионами, амидами металлов, щелочами, алкоголятами, тиоалкоголятами)

Примером может служить щелочной гидролиз нитрилов:
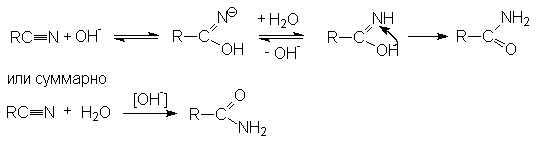
Дальнейший гидролиз
амида приводит к образованию солей
карбоновых кислот.
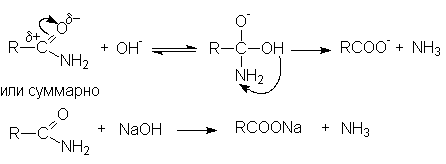
Таким образом суммарное уравнение щелочного гидролиза нитрилов можно представить как
R-C N + H2O + NaOH RCOONa + NH3
Реакции нитрилов со слабыми нуклеофилами (водой, спиртами) протекает крайне медленно. Для эффективного проведения этих реакций используют кислотный катализ. Активация молекулы нитрила в этом случае осуществляется за счет образования водородной связи между кислотой – катализатором и атомом азота и, как следствие, увеличение положительного заряда на нитрильном углеродном атоме.
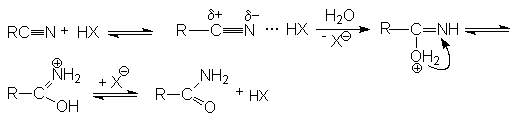
На последующей стадии гидролиза кислота НХ выступает одновременно как ускоритель реакции и реагент.

Таким образом, полный кислотный гидролиз нитрилов описывается уравнением:
R-C N + 2H2O + HX RCOOH + NH4X
Если в качестве реагента использовать водно-спиртовые среды, то можно осуществлять синтез сложных эфиров
R-C N + R'OH + H2O + HX RCOOR' + NH4X
Гидрирование.
Реакции гидрирования нитрилов можно подразделить на две группы:
а) каталитическое гидрирование
![]()
В качестве катализаторов этих реакций используют металлические Pt, Pd, Ni.
б) реагентное гидрирование
![]()
В качестве реагентов этих реакциях используют LiAlH4, NaBH4.
Механизм реакции:
RC N + LiAlH4 RCH=N-Li + AlH3
RCH=N-Li + HX RCH=NH + LiX
Механизм второй стадии:
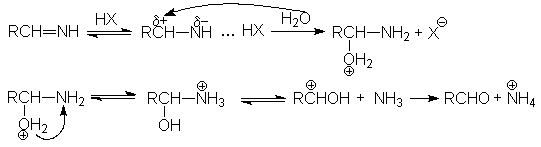
Взаимодействие с металлоорганическими соединениями.
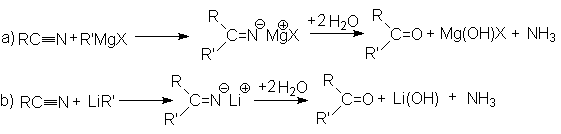
Реакция Риттера.
Эта реакция является примером присоединения атома углерода к гетероатому (азоту).
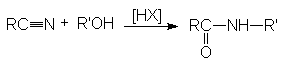
Реакция протекает по карбкатионному механизму:
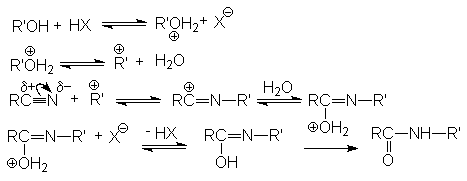
В реакцию вступают только спирты, дающие достаточно стабильные карбкатионы (вторичные, третичные, бензильные и т.п.). Первичные спирты не реагируют. Карбкатионы не обязательно следует генерировать из спирта, его можно получать протонированием алкенов.

ПРОИЗВОДНЫЕ УГОЛЬНОЙ КИСЛОТЫ
Угольную кислоту формально можно рассмотреть как карбоновую кислоту, которая вместо углеводородого остатка содержит гидроксильную группу.
Cвойства производных угольной кислоты в основном подобны свойствам производных карбоновых кислот. Отличие от карбоновых кислот состоит в том, что производные угольной кислоты представляют собой результат замещения одной или двух гидроксильных групп.
Поэтому и те и другие являются бифункциональными соединениями. Это открывает допонительные возможности вариации их структуры, а также делает симметричные структуры потенциальным сырьем для получения поликонденсационных полимеров.
Рассмотрим некоторые наиболее важные производные угольной кислоты.
Фосген Хлоругольная кислота
Фосген является устойчивым соединением, хлоругольная кислота неустойчива, известны ее производные, например эфиры.
Фосген получают свободнорадикальным хлорированием оксида углерода (II)
Фосген и эфиры хлоругольной кислоты проявляют свойства хлорангидридов карбоновых кислот, однако в отличие от последних более реакционноспособны в реакциях нуклеофильного замещения. Они являются реагентами для получения эфиров угольной и хлоругольной кислот.
Если в качестве реагента используют фенолы, то результатом является образование диарилкарбонатов.
Фосген является бифункциональным соединением, поэтому его используют для получения пластмасс – поликарбонатов.
Эфиры угольной кислоты
Эти соединения проявляют свойства обычных эфиров карбоновых кислот, в том числе вступают в реакции сложноэфирной конденсации и поэтому используются в органическом синтезе для введения в структуру органических алкоксикарбонильной группы.
Амиды угольной кислоты
Типичным представителем амидов угольной кислоты является мочевина (карбамид)
В промышленности она может быть получена из аммиака и CO2
Процесс проводят при 180-2000С, 18-20 МПа и 100%-ном избытке NH3. Замещенные мочевины могут быть получены взаимодействием фосгена с аминами
Эта реакция осуществляется ступенчато через промежуточное образование карбаминоилхлорида
Можно видеть, что синтез замещенных мочевин требует применение избытка амина. Если реакцию проводить в избытке фосгена, то количественно образуется карбаминоил хлорид (реакция (1)). Последний может быть использован для получения изоцианатов RN=C=O:
причем реакцию проводят в условиях диссоциации гидрохлорида амина, образующегося на стадии (1) и снова вовлекающегося в реакцию (1).
Суммируя реакции (1), (3), (4), имеем стехиометрию процесса синтеза изоцианата
Изоцианаты используют для получения уретанов (эфиров карбаминовой кислоты)
Cами карбаминовые кислоты RNHCOOH , представляющие собой амиды, нестабильны и легко распадаются на амины(аммиак) и CO2
Практическое значение имеют диизоцианаты, образующие при сополимеризации с двухатомными спиртами полиуретаны.
Полиуреаны применяют для получения синтетических волокон, каучуков, клеев и лаков. Из них получают пенопласты, для чего в процессе полимеризации добавляют немного воды, которая гидролизует часть изоцианитных групп с выделением диоксида углерода.
CO2 вспенивает полимер, придавая ему пористую структуру.
Другой способ получения уретанов (карбаматов) – амидирование эфиров хлоругольной кислоты:
Многие эфиры замещенных карбаминовых кислот являются ценными пестицидами, достаточно легко разлагающимися в природных условиях с образованием малотоксичных соединений. Саму мочевину широко используют в сельском хозяйстве как высококачественное удобрение и кормовую добавку. Другие направления использования мочевины – карбамидная депарафинизация и синтез мочевино – формальдегидных смол
ПРОИЗВОДНЫЕ УГОЛЬНОЙ КИСЛОТЫ
Угольную кислоту формально можно рассмотреть как карбоновую кислоту, которая вместо углеводородого остатка содержит гидроксильную группу.
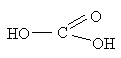
Cвойства производных угольной кислоты в основном подобны свойствам производных карбоновых кислот. Отличие от карбоновых кислот состоит в том, что производные угольной кислоты представляют собой результат замещения одной или двух гидроксильных групп.
Поэтому и те и другие являются бифункциональными соединениями. Это открывает допонительные возможности вариации их структуры, а также делает симметричные структуры потенциальным сырьем для получения поликонденсационных полимеров.
Рассмотрим некоторые наиболее важные производные угольной кислоты.
 Фосген
Хлоругольная кислота
Фосген
Хлоругольная кислота
Фосген является устойчивым соединением, хлоругольная кислота неустойчива, известны ее производные, например эфиры.
Фосген получают
свободнорадикальным хлорированием
оксида углерода (II)
![]()
Фосген и эфиры
хлоругольной кислоты проявляют свойства
хлорангидридов карбоновых кислот,
однако в отличие от последних более
реакционноспособны в реакциях
нуклеофильного замещения. Они являются
реагентами для получения эфиров угольной
и хлоругольной кислот.
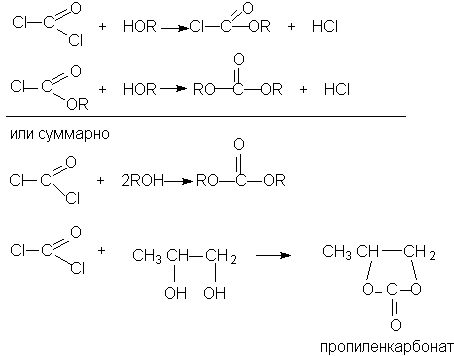 Если
в качестве реагента используют фенолы,
то результатом является образование
диарилкарбонатов.
Если
в качестве реагента используют фенолы,
то результатом является образование
диарилкарбонатов.
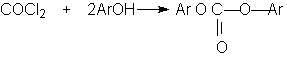 Фосген
является бифункциональным соединением,
поэтому его используют для получения
пластмасс – поликарбонатов.
Фосген
является бифункциональным соединением,
поэтому его используют для получения
пластмасс – поликарбонатов.
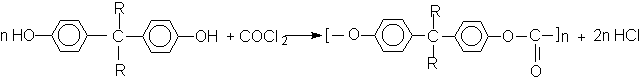
Эфиры угольной кислоты
Эти соединения проявляют свойства обычных эфиров карбоновых кислот, в том числе вступают в реакции сложноэфирной конденсации и поэтому используются в органическом синтезе для введения в структуру органических алкоксикарбонильной группы.
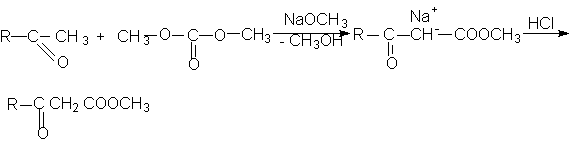
Амиды угольной кислоты
Типичным представителем амидов угольной кислоты является мочевина (карбамид)
![]()
В промышленности она может быть получена из аммиака и CO2
![]() Процесс
проводят при 180-2000С,
18-20 МПа и 100%-ном избытке NH3. Замещенные
мочевины могут быть получены взаимодействием
фосгена с аминами
Процесс
проводят при 180-2000С,
18-20 МПа и 100%-ном избытке NH3. Замещенные
мочевины могут быть получены взаимодействием
фосгена с аминами
![]()
Эта реакция осуществляется ступенчато через промежуточное образование карбаминоилхлорида
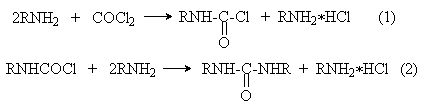 Можно
видеть, что синтез замещенных мочевин
требует применение избытка амина. Если
реакцию проводить в избытке фосгена,
то количественно образуется карбаминоил
хлорид (реакция (1)). Последний может быть
использован для получения изоцианатов
RN=C=O:
Можно
видеть, что синтез замещенных мочевин
требует применение избытка амина. Если
реакцию проводить в избытке фосгена,
то количественно образуется карбаминоил
хлорид (реакция (1)). Последний может быть
использован для получения изоцианатов
RN=C=O:
![]()
причем реакцию проводят в условиях диссоциации гидрохлорида амина, образующегося на стадии (1) и снова вовлекающегося в реакцию (1).
![]()
Суммируя реакции (1), (3), (4), имеем стехиометрию процесса синтеза изоцианата
![]()
Изоцианаты используют для получения уретанов (эфиров карбаминовой кислоты)
![]()
Cами карбаминовые кислоты RNHCOOH , представляющие собой амиды, нестабильны и легко распадаются на амины(аммиак) и CO2
 Практическое
значение имеют диизоцианаты, образующие
при сополимеризации с двухатомными
спиртами полиуретаны.
Практическое
значение имеют диизоцианаты, образующие
при сополимеризации с двухатомными
спиртами полиуретаны.
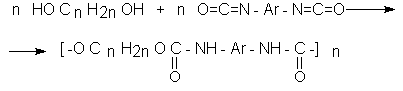 Полиуреаны
применяют для получения синтетических
волокон, каучуков, клеев и лаков. Из них
получают пенопласты, для чего в процессе
полимеризации добавляют немного воды,
которая гидролизует часть изоцианитных
групп с выделением диоксида углерода.
Полиуреаны
применяют для получения синтетических
волокон, каучуков, клеев и лаков. Из них
получают пенопласты, для чего в процессе
полимеризации добавляют немного воды,
которая гидролизует часть изоцианитных
групп с выделением диоксида углерода.
![]()
CO2 вспенивает полимер, придавая ему пористую структуру.
Другой способ получения уретанов (карбаматов) – амидирование эфиров хлоругольной кислоты:
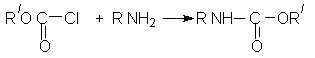
Многие эфиры замещенных карбаминовых кислот являются ценными пестицидами, достаточно легко разлагающимися в природных условиях с образованием малотоксичных соединений. Саму мочевину широко используют в сельском хозяйстве как высококачественное удобрение и кормовую добавку. Другие направления использования мочевины – карбамидная депарафинизация и синтез мочевино – формальдегидных смол. Лекция №38
Двухосновные, ненасыщенные и аренкарбоновые кислоты
План
Дикарбоновые кислоты
a , b -Непредельные карбоновые кислоты.
Ненасыщенные дикарбоновые кислоты.
Аренкарбоновые кислоты.
Дикарбоновые кислоты
Эти соединения могут рассматриваться как результат замещения двух атомов водорода в углеводородах на карбоксильные группы.
Дикарбоновые кислоты можно подразделить на три группы, в зависимости от характера углеводородного остатка – насыщенные, ненасыщенные и арендикарбоновые кислоты.
Методы получения насыщенных дикарбоновых кислот
Окисление -диолов.
![]()
В качестве окислителей можно использовать KMnO4 в нейтральной или кислой среде или K2Cr2O7 в кислой среде.
Окисление циклоалкенов.
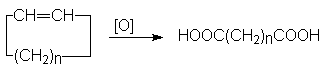 Реакцию
проводят при повышенных температурах,
используя в качестве окислителей
KMnO4 или
K2Cr2O7 в
кислой среде.
Реакцию
проводят при повышенных температурах,
используя в качестве окислителей
KMnO4 или
K2Cr2O7 в
кислой среде.
Окисление циклических кетонов.
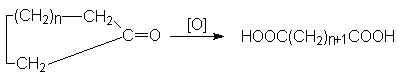 Окислители
– те же, что и при окислении циклоалкенов.
Температура 100-120оС.
Окислители
– те же, что и при окислении циклоалкенов.
Температура 100-120оС.
Гидролиз динитрилов карбоновых кислот.
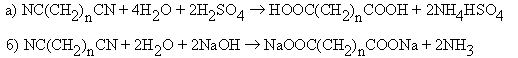
Карбонилирование -диолов.
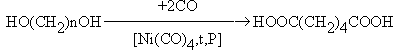
Свойства дикарбоновых кислот
Кислотные свойства
Каждая карбоксильная группа действует на другую как электроноакцептор, повышая ее кислотность, причем с увеличением расстояния между карбоксильными группами их кислотность падает.
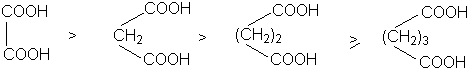
В силу быстрого затухания индуктивного эффекта различие в кислотностях дикарбоновых кислот с ростом длины полиметиленовой кислоты возрастает.
Вторая константа кислотности дикарбоновых кислот ниже, чем первая, поскольку карбоксилат-анион обладает +I – эффектом.
Наиболее важными среди дикарбоновых кислот являются щавелевая, малоновая, янтарная, глутаровая (этан-, пропан-, бутан- и пентандикарбоновая).
Щавелевая кислота – НООС-СООН, бесцветное кристаллическое вещество, растворимое в воде и спиртах и труднорастворимое в углеводородах.
Специфическим способом получения щавелевой кислоты является нагревание формиата натрия.
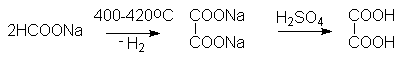
Специфическими реакциями щавелевой кислоты являются разложение в присутствии концентрированной серной кислоты и окисление:
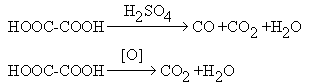
Щавелевую кислоту используют как протраву при крашении тканей и как аналитический агент. Возможно ее использование для получения полиэфиров. Из производных щавелевой кислоты интерес представляет диэтилоксалат С2Н5ООС-СООС2Н5. Для него характерны многие реакции сложных эфиров. Он вступает в реакцию сложноэфирной конденсации (см. конденсацию по Клайзену) в качестве реагента, не содержащего подвижные атомы водорода (см. синтезы на основе ацетоуксусного эфира). Подобный же вид конденсации протекает при взаимодействии диэтилоксалата с кетонами.
Малоновая кислота
НООС(СН2)СООН – бесцветное кристаллическое вещество, растворимое в воде.
Специфичный способ получения – из хлоруксусной кислоты
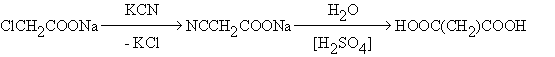
Малоновая кислота легко декарбоксилируется при нагревании выше 133-135оС или при кипячении водных растворов в присутствии кислот.
![]()
Малоновая кислота содержит очень активную метиленовую группу с подвижными атомами водорода. Поэтому малоновая кислота и ее эфиры вступают в реакции конденсации, протекающие по карбанионному механизму:
а) конденсация с альдегидами и кетонами (реакция Кневенагеля):
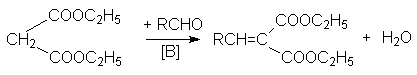
б) реакция Михаэля
– сопряженное присоединение
к -ненасыщенным
системам:
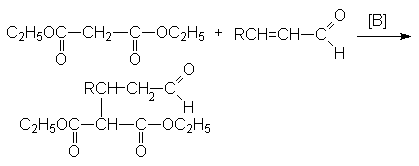
Янтарная кислота – HOOC(CH2)2COOH – бесцветное кристаллическое вещество, растворимое в воде и спиртах.
В промышленности ее получают гидрированием малеиновой кислоты
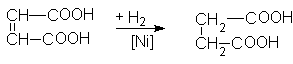
и карбонилированием этиленгликоля
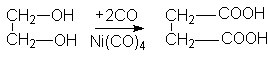
Для янтарной кислоты характерны все реакции карбоксильной группы. Особенность янтарной кислоты – способность к циклизации. Наиболее важными реакциями циклизации являются образование янтарного ангидрида
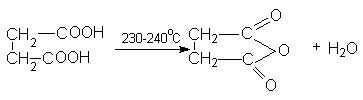
и сукцинимида:
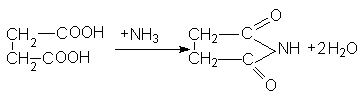
Важным производным сукцинимида является бромсукцинимид, который используется для окисления и бромирования органических соединений (см. аллильное бромирование алкенов).
Получается бромсукцинимид путем бромирования сукцинимида в присутствии щелочей.
Молекула янтарной кислоты содержит две активированные метиленовые группы. Их активность уступает активности метиленовой группы в малоновой кислоте, но достаточна для осуществления реакций галогенирования и конденсации с альдегидами и кетонами в более жестких условиях.
Янтарная кислота и ее эфиры - исходные вещества для получения полиэфирных волокон и лекарственных веществ.
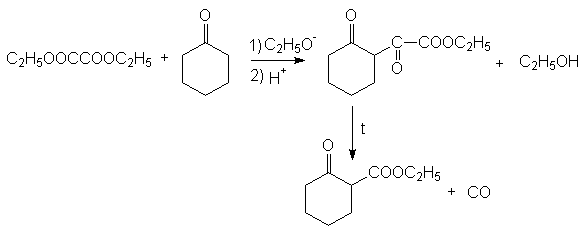
Адипиновая кислота.
Получается окислением циклогексанона азотной кислотой:
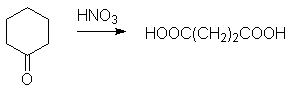
и карбонилированием 1,4-бутандиола и тетрагидрофурана:
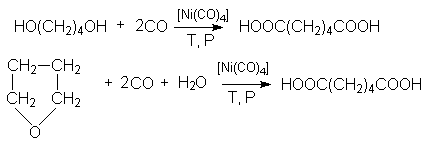
Адипиновая кислота используется для получения волокна найлон.
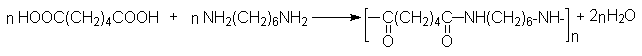
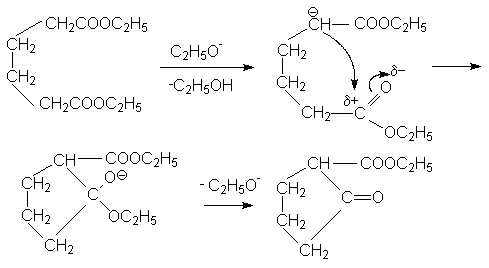
Эфиры адипиновой кислоты и ее ближайших гомологов используются для получения средних и больших циклов. В этом плане важными синтезами являются:
Ацилоиновая
конденсация:

Конденсация по
Дикману:
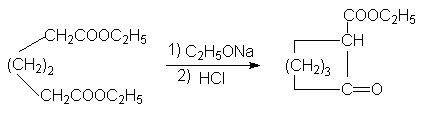
Механизм последней
реакции подобен механизму конденсации
по Кляйзену
Непредельные карбоновые кислоты.
Методы синтеза
Дегидратация -оксикислот
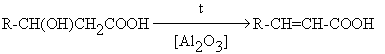
Дегидрогалогенирование солей галогенкарбоновых кислот
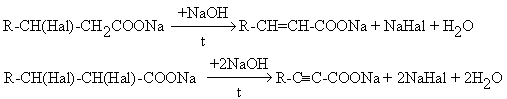
с последующим подкислением продуктов реакции.
Гидрокарбоксилирование алкинов
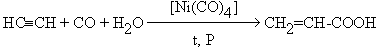
реакция Кневенагеля
![]()
реакция Виттига (взимодействие альдегидов с алкоксикарбонилфосфоранами)
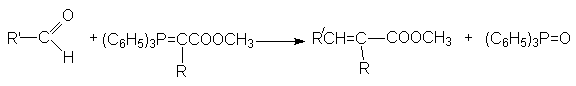
Химические свойства
Подобно алкенам двойные связи ненасыщенных кислот могут присоединять бром, эпоксидироваться , гидробромироваться , хотя эти реакции оказываются более медленными по сравнению с соответствующими реакциями алкенов, что связано с дезактивирующим действием карбоксильной группы.
Присоединение воды, HBr и других реагентов, имеющих подвижный водород, идет против правила Марковникова
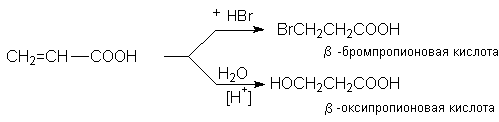
Первый акт взаимодействия связан с протонированием карбонильного кислорода, приводящего к образованию положительно заряженного реакционного центра на углеродном атоме:
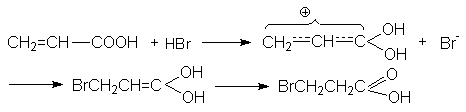
Присоединение галогенов идет стерeоспецифично через образование неклассического циклического катиона с последующим присоединением галогенид-аниона в транс-положение
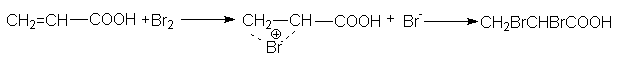
Эпоксидирование происходит с сохранением конфигурации алкена: из цис-алкенов образуются цис-эпоксиды, из транс-алкенов – транс-эпоксиды, например
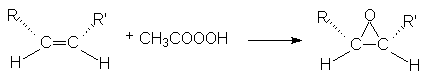
Ненасыщенные дикарбоновые кислоты
Важнейшими из соединений этого ряда являются малеиновая кислота и фумаровая кислота, которые относятся друг к другу как цис- и транс- изомеры.
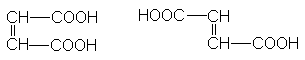
Малеиновая кислота получается каталитическим парофазным окисление бензола и бутена –2.
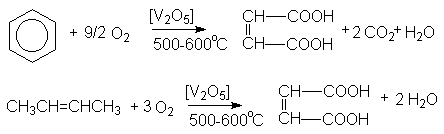
Фумаровая кислота получается фотохимической изомеризацией малеиновой кислоты.
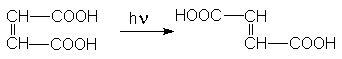
Фумаровая и малеиновая кислоты могут использоваться в качестве сырья для получения полиэфирных волокон.
![]()
Аренкарбоновые кислоты
Классификация, номенклатура, изомерия.
Аренкарбоновые кислоты содержат карбоксильную группу в ароматическом кольце или боковой цепи. По количеству карбоксильных групп различают моно-, ди- и поликарбоновые кислоты. Примеры номенклатуры аренкарбоновых кислот и их замещенных приведены в таблице.
Формула |
Тривиальное название |
Систематическое название |
|
Бензойная |
Бензолкарбоновая |
|
о-Толуиловая |
2-Метилбензойная |
|
Фенилуксусная |
Фенилэтановая |
|
Коричная |
3-Фенилпропеновая |
|
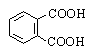
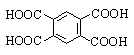
Фталевая |
1,2-Бензолдикарбоновая |
|
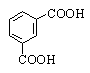
Изофталевая |
1,3-Бензолдикарбоновая |
|
Терефталевая |
1,4-Бензолдикарбоновая |
|
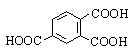
Тримеллитовая |
1,2,4-Бензолтрикарбоновая |
|
Пиромеллитовая |
1,2,4,5-Бензолтетракарбоновая |
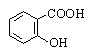
|
Салициловая |
2-Гидроксибензойная |
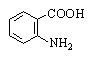
|
Антраниловая |
2-Аминобензойная |
Аренмонокарбоновые кислоты
1. Методы получения 1)Реакции окисления Аренкарбоновые кислоты, содержащие карбоксильую группу, связанную с ароматическим кольцом, получают окислением алкиларенов (см. лекцию №17).
![]()
В качестве окислителей используют KMnO4, Na2Cr2O7, кислород в присутствии солей Co и Mn.
Метилкетоны также могут быть окислены в кислоты, лучше всего действием галогенов в щелочной среде (галоформная реакция):
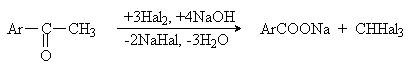
2) Реакции гидролиза Наиболее широко используют гидролиз нитрилов, которые могут быть получены из галогенаренов или солей арилдиазония:
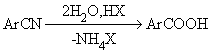
3) Карбоксилирование магний- и литийорганических соединений
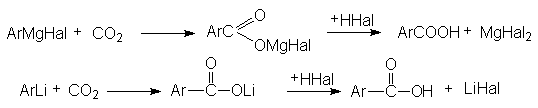
4) Карбоксилирование фенолятов (реакция Кольбе-Шмидта)