
- •3.Основные термодинамические параметры состояния.
- •4. Виды и формы обмена энергией.
- •11 Обратимые и необратимые процессы
- •13. Энтальпия
- •15. Удельная (массовая), объёмная и молярная теплоёмкость.
- •19. Второй закон термодинамики.
- •2 0. Круговые термодинамические прочессыю
- •2 3. Обратный обратимый цикл Карно:
- •26.Классификация холодильных установок, хладогенты и требования к ним.
- •27 Цикл воздушной холодильной установки(в.Х.У.)
- •29. Типы паровых турбин. Классификация паровых турбин.
- •30. Конструкции основных деталей паровых турбин.
- •32 Активная и реактивная ступени паровых турбин.
- •33.Активные турбины со ступенями скорости
- •35.Цикл Ренкина
- •37.Теплопроводность
- •39. Теплопроводность циклической стенки трубы.
- •40Конвективный теплообмен. Виды движения теплоносителей.
- •42. Динамический и конвективный пограничные слои:
- •45.Расчет рекуперативных теплообменных аппаратов
- •48 Рабочий процесс и теоретические индикаторные диаграммы карбюраторных двигателей.
- •4 9.Рабочий процесс, теоретические и индикаторные диаграммы дизелей.
- •51 Классификация котельных установок.
- •53. Тепловой баланс ку и кпд котельного агрегата:
- •55.Пароперегреватели.
- •56 Экономайзеры ку. Назначение, конструкция, виды.
- •57. Воздухоподогреватели
- •59. Классификация нагнетателей. Область применения.
- •60. Производительность, напор и давление, создаваемое нагнетателем.
- •62. Теплоснабжение. Классификация систем теплоснабжения.
- •63.Тепловые эл.Станции. Классификация тэс. Потребление эл.Энергии и тепла.
- •64 Ресурсы потребляемые на аэс, её продукты и отходы производства.
- •68. Типы тепловых электростанций. Классификация.
- •70.Преимущества и недостатки тэс
- •72.Парогазовые установки. Их классификация. Достоинства и недостатки.
15. Удельная (массовая), объёмная и молярная теплоёмкость.
Различают удельную (массовую), объёмную и молярную теплоёмкость.
Удельная
массовая теплоёмкость
![]() величина = отношению теплоёмкости к
его массе. [Дж/кг*К]
величина = отношению теплоёмкости к
его массе. [Дж/кг*К]
Объёмная
теплоёмкость
![]() называется отношением теплоёмкости
рабочего тела к его объёму. При [Дж/м3
*К]
называется отношением теплоёмкости
рабочего тела к его объёму. При [Дж/м3
*К]
Молярной теплоёмкостью Сm называют величину = произведение удельной теплоёмкости на молярную массу. [Дж/моль*К]
Сх=Сx`*V0=Cm/м
Теплоёмкость при p=const и v=const.Уравнение Майера
Отношение кол-ва теплоты δq к изменению температуры dT наз. удельной теплоёмкостью
Изохорная теплоемкость: Cv=δqv/dT
Изобарная теплоемкость: Cp=δqp/dT
Уравнение Майера: Cp= Cv+R
17.
Средняя теплоемкость. Так
как теплоемкость идеального газа зависит
от температуры, а реального – от давления,
то в технической термодинамике различают
истинную (Cx)
и среднюю (![]() )
теплоемкости.
)
теплоемкости.
![]()
![]()
![]() Истинной
теплоемкостью
называется отношение элементарного
кол-ва теплоты сообщаемой термодинамической
системы в каком-либо процессе к бесконечно
малой разности температур dt.
Истинная теплоемкость реальных газов:
Cx=Cxo+ΔCx.
Cxo
– теплоемкость реального газа в
разряженном состоянии. ΔCx
определяет зависимость теплоемкости
от давления или удельного объема и
связана с изменением потенциальной
составляющей внутренней энергии
реального газа. Средней
теплоёмкостью
данного процесса в интервал температуры
от t1 до t2
называют отношение кол-ва теплоты,
полученной в процессе 1-2, к разности
температур t1-t2.
Истинной
теплоемкостью
называется отношение элементарного
кол-ва теплоты сообщаемой термодинамической
системы в каком-либо процессе к бесконечно
малой разности температур dt.
Истинная теплоемкость реальных газов:
Cx=Cxo+ΔCx.
Cxo
– теплоемкость реального газа в
разряженном состоянии. ΔCx
определяет зависимость теплоемкости
от давления или удельного объема и
связана с изменением потенциальной
составляющей внутренней энергии
реального газа. Средней
теплоёмкостью
данного процесса в интервал температуры
от t1 до t2
называют отношение кол-ва теплоты,
полученной в процессе 1-2, к разности
температур t1-t2.
![]() Т.к.
кол-во теплоты
Т.к.
кол-во теплоты
![]() неизменная величина в каком-либо процессе
(const),
то выражение средней теплоемкости можно
преобразовать:
неизменная величина в каком-либо процессе
(const),
то выражение средней теплоемкости можно
преобразовать:![]() Это
уравнение устанавливает связь между
истинной и средней теплоемкостями в
данном процессе. Если средние теплоемкости
даны в таблице в интервале температур
от 0 до величины t,
то
Это
уравнение устанавливает связь между
истинной и средней теплоемкостями в
данном процессе. Если средние теплоемкости
даны в таблице в интервале температур
от 0 до величины t,
то
![]() может быть определена по выражение:
может быть определена по выражение:
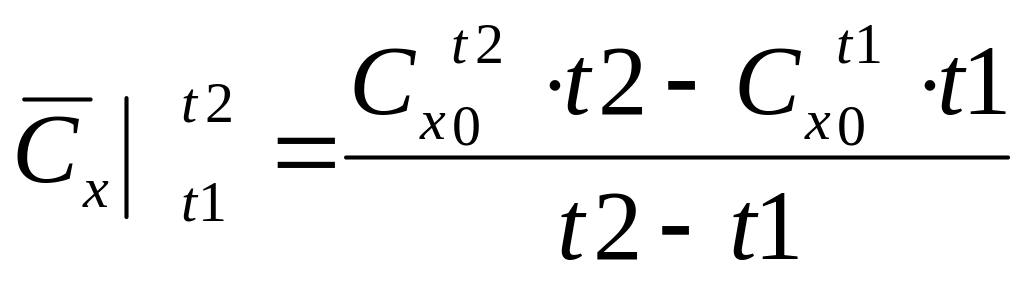 Средняя
теплоемкость равна высоте прямоугольника
3456, площадь которого определяется
точками 1,2,3,4.
Средняя
теплоемкость равна высоте прямоугольника
3456, площадь которого определяется
точками 1,2,3,4.
18. Термодинамические процессы идеальных газов. К основным процессам отн-ся: изохорный (V=const),изобарный(P=const), изотермический(T=const), адиабатный(PV=const), политропный(c=const).
ΔU=U2-U1=∫cvdt; U2-U1=cv(t2-t1); l=∫VdP; l=∫PdV; PV=RT; P1/P2=T1/T2; q1-2=∫cxdt.Изохорный процесс: l’=-∫VdP=-V(P2-P1). Если процесс 1-2 осуществляется с увеличением давления, то удельное кол-во теплоты q1-2 подводится, при этом увелич. внутр. энергия ΔU и температура газа. S2-S1=cv*ln(T2/T1)+R*ln(P2/P1); S2-S1=cv*ln(T2/T1)=cv*Ln(P2/R)Изобарный процесс:
V2/V1=T2/T1; l=∫PdV=P(V2-V1); l’=-∫VdP=0; S2-S1=cp*ln(T2/T1)+R*ln(P2/P1); S2-S1=cp*ln(T2/T1)=cp*ln(V2/V1) Изотермический процесс:
P1V1=P2V2; P1/P2=V2/V1; q1-2=l1-2. Кол-во подведенной к телу теплоты q1-2=кол-ву работы по изменению объема. Работа: l=∫PdV=P1V1∫(dV/V)=P1V1*ln(V2/V1); l’=-∫VdP=P1V1∫(dP/P)=P1V1*ln(P2/P1); S2-S1=cv*ln(T2/T1)-R*ln(P2/P1)=cv*ln(V2/V1); q1-2=l1-2; S2-S1=R*ln(V2/V1)=R*ln(P1/P2).Адиабатный процесс: dq=0; PV =const; (P1/P2)=(V2/V1); (V2/V1)=(P1/P2) =(P1/P2) ; T1/T2=(V2/V1) ; l=(1/(k-1))*(P1V1-P2V2)=(R/(k-1))*(T1-T2)=(P1V1/(k-1))(1-T2/T1); l’=k*l; l’=(k/(k-1))(P1V1-P2V2)Политропный процесс: δq=cn*dt; q=cn(t2-t1); n=(cn-cp)/(cn-cr); PVⁿ=const; n*ln(V2/V1)=ln(P1/P2). Для каждого процесса показатель политропы n имеет своё значение: 1)для изохорного: n=±∞, cn=cv; 2)для изобарного: n=0, cn=cv=cp; 3)для изотермического: n=1, cp=±∞; 4)для адиабатного:n=k, cn=0. P1/P2=(V2/V1)ⁿ; T2/T1=(V1/V2) =(P2/P1) ; S2-S1=cn*ln(T2/T1)=cv*((n-k)/(n-1))*ln(T2/T1).
