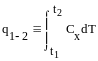- •3.Основные термодинамические параметры состояния.
- •4. Виды и формы обмена энергией.
- •11 Обратимые и необратимые процессы
- •13. Энтальпия
- •15. Удельная (массовая), объёмная и молярная теплоёмкость.
- •19. Второй закон термодинамики.
- •2 0. Круговые термодинамические прочессыю
- •2 3. Обратный обратимый цикл Карно:
- •26.Классификация холодильных установок, хладогенты и требования к ним.
- •27 Цикл воздушной холодильной установки(в.Х.У.)
- •29. Типы паровых турбин. Классификация паровых турбин.
- •30. Конструкции основных деталей паровых турбин.
- •32 Активная и реактивная ступени паровых турбин.
- •33.Активные турбины со ступенями скорости
- •35.Цикл Ренкина
- •37.Теплопроводность
- •39. Теплопроводность циклической стенки трубы.
- •40Конвективный теплообмен. Виды движения теплоносителей.
- •42. Динамический и конвективный пограничные слои:
- •45.Расчет рекуперативных теплообменных аппаратов
- •48 Рабочий процесс и теоретические индикаторные диаграммы карбюраторных двигателей.
- •4 9.Рабочий процесс, теоретические и индикаторные диаграммы дизелей.
- •51 Классификация котельных установок.
- •53. Тепловой баланс ку и кпд котельного агрегата:
- •55.Пароперегреватели.
- •56 Экономайзеры ку. Назначение, конструкция, виды.
- •57. Воздухоподогреватели
- •59. Классификация нагнетателей. Область применения.
- •60. Производительность, напор и давление, создаваемое нагнетателем.
- •62. Теплоснабжение. Классификация систем теплоснабжения.
- •63.Тепловые эл.Станции. Классификация тэс. Потребление эл.Энергии и тепла.
- •64 Ресурсы потребляемые на аэс, её продукты и отходы производства.
- •68. Типы тепловых электростанций. Классификация.
- •70.Преимущества и недостатки тэс
- •72.Парогазовые установки. Их классификация. Достоинства и недостатки.
11 Обратимые и необратимые процессы
Р авновесный
процесс А-B
в котором газ расширяясь проходит через
равновесное состояние A1,2B.
В этом процессе получилась работа
расширения Ар=Sabcd.
Для того, чтобы рабочее тело привести
в первоначальное состояние необходимо
от точки B
провести процесс сжатия. Если увеличить
давление на dp,
то поршень переместится на величину dV
и сожмёт газ в цилиндре до P+dp.
Затраченная работа в процессе сжатия
хар-ся площадью lсж.=Sbadc;
lрас.=lсж.
При таких условиях все точки прямого
процесса сольются со всеми точками
обратного процесса. Такие процессы,
протекающие в прямом и обратном
направлениях без остаточных изменений,
как в самом рабочем теле, так и окр. среде
наз. обратимыми. Таким образом любой
равновесный термодинамический процесс
изменения состояния рабочего тела
всегда будет обратимым термодинамическим
процессом. Термодинамический процесс,
который проходит через неравновесные
состояния наз. необратимым. В результате
необратимых процессов в прямом и обратном
направлениях термодинамическая система
не возвратится в первоначальное состояние
без затраты из вне энергии.
авновесный
процесс А-B
в котором газ расширяясь проходит через
равновесное состояние A1,2B.
В этом процессе получилась работа
расширения Ар=Sabcd.
Для того, чтобы рабочее тело привести
в первоначальное состояние необходимо
от точки B
провести процесс сжатия. Если увеличить
давление на dp,
то поршень переместится на величину dV
и сожмёт газ в цилиндре до P+dp.
Затраченная работа в процессе сжатия
хар-ся площадью lсж.=Sbadc;
lрас.=lсж.
При таких условиях все точки прямого
процесса сольются со всеми точками
обратного процесса. Такие процессы,
протекающие в прямом и обратном
направлениях без остаточных изменений,
как в самом рабочем теле, так и окр. среде
наз. обратимыми. Таким образом любой
равновесный термодинамический процесс
изменения состояния рабочего тела
всегда будет обратимым термодинамическим
процессом. Термодинамический процесс,
который проходит через неравновесные
состояния наз. необратимым. В результате
необратимых процессов в прямом и обратном
направлениях термодинамическая система
не возвратится в первоначальное состояние
без затраты из вне энергии.
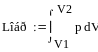 ,
p- давление рабочего тела
,
p- давление рабочего тела
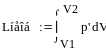 , p'- давление внешней среды
, p'- давление внешней среды
L обр.> Lнеобр. – расширение; L обр.> Lнеобр.- сжатие
С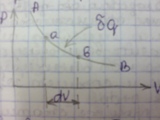 увеличением рабочего объёма на величину
dV
тело совершает внешнюю работу dL
по преодолению внешних сил:
увеличением рабочего объёма на величину
dV
тело совершает внешнюю работу dL
по преодолению внешних сил:
![]() -
изменение внутр. энергии
-
изменение внутр. энергии
![]()
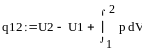
12. Аналитическое выражение 1-го закона термодинамики. Первый закон вытекает из всеобщего закона сохранения и превращения энергии. Он гласит, что в изолированной системе сумма всех видов энергии является величиной постоянной, значит, что уменьшение какого-либо вида энергии в одной системе сопровождается увеличением энергии в другой системе. Зависимость между тепловой и полученной работой: Q=A*L, A-тепловой эквивалент работы. Он зависит от системы единиц, выбранных для измерения теплоты и работы. Если теплота и работа выражается в одних единицах, то Q=L, где Q-тепло, L-полученная в результате его использованная работа. Энергия к рабочему телу подводится или отводится от него лишь в форме тепла или механической работы. Поэтому Q=U+L, где Q-сумма кол-во подведённого к термодинамической системе тепла, U-изменение внутренней энергии термодинамической системы, L-суммарная работа изменения объёма термодинамической системы.
13. Энтальпия
Удельная энтальпия это отношение энтальпии к массе тела
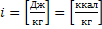
![]()
![]() , Cp
–
удельная теплоемкость, Т – температура.
, Cp
–
удельная теплоемкость, Т – температура.
Если в качестве независимых параметров выбрать давление и температуру, то модно получить для обратимых процессов.
![]()
![]()
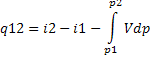
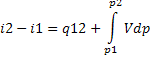
У дельная
энтальпия больше внешней теплоты q
на величину Vdp.
дельная
энтальпия больше внешней теплоты q
на величину Vdp.
Изменение удельной энтальпии во всех процессах, протекающих в одинаковых точках АВ одинаково.
i= энергии расширенной системы тела и окружающей среды.
В
этом заключается физический
смысл энтальпии:
![]() ,
где Е – полная энергия системы, состоящая
из удельной внутренней газа U
и потенциальной энергии PV
(поршень с газом).
,
где Е – полная энергия системы, состоящая
из удельной внутренней газа U
и потенциальной энергии PV
(поршень с газом).
14. Теплоёмкость газа.
Отношение элементарного количества теплоты ∂q, при бесконечно малом его изменении его состояния, к изменению температуры называется удельной теплоёмкостью.
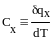
Х-способ подвода теплоты
Величина q в данном выражении зависит не только от интервала температур, но и от способа подвода теплоты.
Общее количество теплоты подведенное в некотором процессе 1-2 может выражаться по следующему выражению.