
- •3.Основные термодинамические параметры состояния.
- •4. Виды и формы обмена энергией.
- •11 Обратимые и необратимые процессы
- •13. Энтальпия
- •15. Удельная (массовая), объёмная и молярная теплоёмкость.
- •19. Второй закон термодинамики.
- •2 0. Круговые термодинамические прочессыю
- •2 3. Обратный обратимый цикл Карно:
- •26.Классификация холодильных установок, хладогенты и требования к ним.
- •27 Цикл воздушной холодильной установки(в.Х.У.)
- •29. Типы паровых турбин. Классификация паровых турбин.
- •30. Конструкции основных деталей паровых турбин.
- •32 Активная и реактивная ступени паровых турбин.
- •33.Активные турбины со ступенями скорости
- •35.Цикл Ренкина
- •37.Теплопроводность
- •39. Теплопроводность циклической стенки трубы.
- •40Конвективный теплообмен. Виды движения теплоносителей.
- •42. Динамический и конвективный пограничные слои:
- •45.Расчет рекуперативных теплообменных аппаратов
- •48 Рабочий процесс и теоретические индикаторные диаграммы карбюраторных двигателей.
- •4 9.Рабочий процесс, теоретические и индикаторные диаграммы дизелей.
- •51 Классификация котельных установок.
- •53. Тепловой баланс ку и кпд котельного агрегата:
- •55.Пароперегреватели.
- •56 Экономайзеры ку. Назначение, конструкция, виды.
- •57. Воздухоподогреватели
- •59. Классификация нагнетателей. Область применения.
- •60. Производительность, напор и давление, создаваемое нагнетателем.
- •62. Теплоснабжение. Классификация систем теплоснабжения.
- •63.Тепловые эл.Станции. Классификация тэс. Потребление эл.Энергии и тепла.
- •64 Ресурсы потребляемые на аэс, её продукты и отходы производства.
- •68. Типы тепловых электростанций. Классификация.
- •70.Преимущества и недостатки тэс
- •72.Парогазовые установки. Их классификация. Достоинства и недостатки.
1. Развитие энергетики в мире и Беларуси. Промышленность и энергетика как основные и тесно взаимосвязанные отрасли представляют собой совокупность предприятий, обеспечивающих производственную базу любой страны. Особо важное значение имеет электрическая энергия в силу универсальности ее применения в промышленности, на транспорте или в быту. Электрическую энергию вырабатывают на ТЭЦ, АЭС, ГЭС. Тип электрической станции зависит от источника от источника потребляемой энергии, при этом независимо от типа станции, электроэнергию вырабатывают централизованно. Это значит, что отдельные электростанции работают параллельно на общую электрическую сеть и объединены в электро системы, которые охватывают значительное число потребителей. Достоинства централизованного электроснабжения: 1. Уменьшается необходимая резервная мощность; 2. Снижается себестоимость вырабатываемой электроэнергии.
2.Техническая термодинамика. Предмет термодинамики. Предметом современной термодинамики явл. изучение наиболее общих св-в макроскопических тел, к-ые не зависят от строения этих тел и к-ые проявляются в процессах обмена энергией между телами. Различают техническую и химическую термодинамику. В тех. термодинамике общие методы изучения энергетических явлений применяют для исследования процессов, сопровождающих обмен энергией в тепловой и механической формах. Техн. термодинамика дает возможность построить теорию тепловых машин, составляющих основу современной энергетики. Хим. термодинамика представляет собой приложение общих термодинамических законов, к явлениям, в к-ых процессы обмена энергией сопровождается изменениями хим. состава участвующих тел. Термодинамика базируется на 2-х законах, получ. название 1-ого и 2-ого начала термодинамики. 1-ый: вытекает из всеобщего з-на сохранения и превращения энергии. 2-ой: устанавливает условие для взаимного превращения работы и теплоты, а также указывает определенную направленность изменений, возникающих во всех реальных процессах обмена энергией.
3.Основные термодинамические параметры состояния.
Параметрами состояния могут быть целый ряд величин: удельный объём, абсолютное давление, абсолютная температура, внутренняя энергия, энтальпия и т.д.
Удельный объём- это величина характеризуемая отношением объёма к массе вещества:
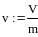 ,
,
![]()
Плотность- это обратное соотношение:
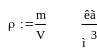
Давление- это соотношение силы, прилагаемой к данной поверхности: P(мм.рт.ст.),(Бар),(Па),(Н/м2),(кг*с/м2)
Для измерения давления применяются барометры и монометры. Давление ниже атмосферного называется вакуумом и измеряется вакуумом-метром.
Абсолютное давление- это давление, отсчитываемое от абсолютного нуля:
![]()

![]()
![]()
Температура характеризует степень нагретости тела.
Абсолютная температура:
T= t+273
4. Виды и формы обмена энергией.
Первой формой, изученной наукой была механическая форма движения. К середине 19 в.
Была изучена тепловая, электрическая, химическая, магнитная и другие формы движения. Найдены количественные меры для каждой из них. При этом установлено, что передача движения от одних тел к другим может происходить как без изменения , так и с изменением формы движения. В первом случае уменьшение движения некоторой формы в одном теле сопровождается таким же увеличением той же формы в другом теле – принцип сохранения движения. Во втором случае уменьшение движения некоторой формы в одном теле сопровождается увеличением в другом теле движения иной формы – принцип превращения движения.
Энергия – это общая количественная мера для всех форм движения материи, способных превращаться одна в другую.
Тепловым движением называют хаотическое, механическое движение большого количества микро частиц, составляющих макроскопические тела.
Передача энергии от одних тел другим происходит в результате взаимодействия этих тел.
5 Термодиномическая система. Термодинамическое равновесие Термодиномической системой называется та совакупность макроскопических тел, которая является обектом термодинамичеспого анализа в каждом конкретном случаи.Обьектом изучения в термодинамике часто являются какое-либо вещество, выполняющуе главную функцию (пар, прдукты згорания, газ, вода) . Такое вещество называется рабочим телом. Тела, невходящие в термодинамическую систему, определяются понятием окружающая среда.Границей между термодинамической системой и окружающей средой называют контрольной поверхностью. Если термодинамическая система не имеет никаких взаимодействий с окружающей средой, то её называют изалированой (замкнутой системой). Система окружённая так называемой адиабатной оболочкой невключающей теплообмен с окружающей средой, называют теплоизолированной или адиобатной системой. Система, имеющая во всех своих частях одинаковый состав и физические свойства, называются однородной. Однородная термодинамическая система внутри которой нет поверхностей раздела фаз, называется гомогеной. Система, состоящая из нескольких макроскопических частей, разделённых одна от другой взаимными поверхностями раздела называются гетерогенной. Гомогенные части системы, отделённые от остальных частей видимыми поверхностями раздела называются фазами. Если состояние тел, входящих в термодинамическую систему длительное время не изменяется, то считается, что система находится в термодинамическом равновесии. При термодинамическом равновесии передача теплоты от одних тел системы к другим и механическое перемещение отдельных частей системы относительно друг друга отсутствуют, таким образом имеет место тепловое и механическое равновесии.
№6
Теплота и работа- способы передачи энергии от одного тела к другому.1-ый способ-реализуется при непосредственном контакте тел, имеющих различную t, путём обмена кин. энергией между молекулами соприк-ся тел или лучистым переносом внутр. энергии излучающих тел путём электромагн. волн. Энергия передаётся от более нагретого тела к менее нагретому.полученное телом кол-во теплоты-подведенное,а кол-во энергии отданной от тела-отданной теплотой.2-ой-связан с наличием силовых полей или внешнего давления. Передача энергии происходит при перемещении всего тела или его части в пространстве. Затраченная телом работа-положительная, а совершённая над ним-отрицательная.
7.
Уравнение состояния идеальных газов:
PV=RT
R-удельная газовая постоянная
PV=mRT - характеристическое ур-е состоян. идеал. газа.
PVm=MRT - Ур-е для одного моля газа
8
Газовая постояннаяИдеальной
газовой постоянной называется такая
постоянная, которая полностью подчиняется
законам Бойля –Мариотта и Гей-Люссака.
В идеальных газах отсутствуют силы
взаимного притяжения и отталкивания
между молекулами объема самих молекул.
Самих молекул приближенно мало по
сравнению с газом. Все реальные газы
при высоких температурах и малых
давлениях также по свойствам подходят
под понятие идеальной газовой состояния
идеального газа – она представляет
состояние реального газа, когда р.→0.Зк.
Бойля –Мариотта установил зависимость
между удельным объемом идеального газа
и его абсолютным давлением при t=cоnst.
При t=cоnst
удельный объем занимаемый газом обратно
пропорционален его давлению:
![]() =
=![]() при постоянной температуре произведение
pv=const.
при постоянной температуре произведение
pv=const.
V1p1=V2p2, pV=const.
К ривая
изотерма:
ривая
изотерма:
Зк.
Гей-Люссака: объемы одного и того же
количества идеального газа изменяются
прмо пропорционально его температуры:![]() =
=![]()
![]() =
=![]() (*)
(*) ![]() =const
=const
Уравнение (*) показывает, что произведение удельного объема идеального газа на давление и деленное на абсолютную температуру есть const.
R= ; R- удельная газовая постоянная
pV=RT- характеризующее уравнение состояния идеального газа.
pV=mRT
R=[![]() ]
]
уравнение состояния для 1 моля газа
pVm=МRT : pV-универсальная газовая постоянная
Rm=8,314
[![]() ]
]
pVm=8,314T
9.CМЕСЬ ИДЕАЛЬНЫХ ГАЗОВ
Под газовой смесью понимают смесь отдельных газов,не вступ.м-у собою ни в какие хим. р-ции. Газовая смесь идеальных газов подчиняется з.Дальтона:
Общее давление смеси газов равно сумме парциальных давлений отдельных газов ,составляющих смесь:
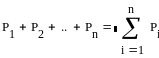
Парциальным наз. давление,которое создают молекулы газа на стенке сосуда,или –это давление,которое имел каждый газ,входящий в состав смеси,если бы этот газ находился в том же кол-ве, в том же объеме и при той же температуре,что и в смеси.
СПОСОБЫ ЗАДАНИЯ СМЕСИ ГАЗОВ
массовыми g=m1/m
объемными r1=v1/v
молярными
Парциальным объемом газа называется объем,который занимал бы этот газ при условии,что его давление и температура равны температуре и давлению смеси газов.
Парциальный объем газа определ.из з.Бойля-Мариотта:
V1=P1V/P g1+g2+...+gn=1
r1+r2+…+rn=1
10.
Первый закон термодинамики.
Закон сохранения и превращения гласит: в изолированной системе сумма всех видов энергии является постоянной. Это значит, что уменьшение какого-либо вида энергии в одной системе сопровождается увеличением в другой системе.
Робертом Майером в 1842 г. Была установлена пропорциональная зависимость между теплотой и полученной работой, а также определено количественное соотношение между ними: Q=A*L
тепловой эквивалент работы.
Тепловой эквивалент работы зависит от системы единиц, выбранных для измерения теплоты и работы.
Если теплота и работа выражаются в одинаковых единицах, то Q = L.
