
Отчёт (Большой практикум) Выращивание микроорганизмов Cupriavidus eutrophus с различными концентрации азота
.docxФедеральное государственное автономное
образовательное учреждение высшего образования
«СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ»
Институт фундаментальной биологии и биотехнологии
Базовая кафедра биотехнологии
ОТЧЁТ ПО БОЛЬШОМУ ПРАКТИКУМУ
Выращивание микроорганизмов Cupriavidus eutrophus B-10646 с различными концентрации азота
Преподаватель: Жила Н.О.
|
|
Подпись, дата
|
|
Должность, ученая
|
|
Инициалы, фамилия |
Студент: ББ16-34Б Широкова.К.
|
|
Номер группы, зачетной книжки
|
Подпись, дата |
|
|
Инициалы, фамилия |
Красноярск 2019
Методика:
Бактерии Cupriavidus eutrophus B-10646 выращивали в стеклянных колбах объемом 0,5л, заполненных культурой на 40% объема на термостатируемой качалке Innova 44 Incubator Shaker Series при температуре 30оС. Для выращивания бактерий за основу была принята солевая среда Шлегеля следующего состава (г/л): Na2HPO4 . H2O – 9,1; KH2PO4 – 1,5; MgSO4 . H2O – 0,2; Fe3C6H5O7 . 7H2O – 0,25; NH4Cl – 1,5 (превышение стандартной концентрации на 0.5); стандартный раствор микроэлементов по Хоагланду (из расчета 3 мл стандартного раствора на 1 л среды) стандартный раствор содержит: H3BO3 – 0,228; CoCe26H2O – 0,030; СuSO4 5H2O – 0,008; MnCe24H2O – 0,008; ZnSO47H2O – 0,176; NaMoO42H2O – 0,050; NiCe2 – 0,008 (г/л)).
В качестве источника углерода использовалась фруктоза (20 г/л).
Оптическая плотность:
Периодически отбирали пробы культуры и измеряли оптическую плотность на фотоколориметре Unico при λ=440нм и длине оптического пути 1мм. Для этого делали разведение культуры с дистиллированной водой в соотношении 1:5.
Начальная оптическая плотность – 0,152 Конечная оптическая плотность – 0,473
*оптическую плотность измеряли без разведения
Биомасса:
Биомассу бактерий в культуре определяли весовым способом. Для этого 20 мл бактериальной суспензии центрифугировали 8 мин при 6000 g в центрифуге Ependorf 5810R. Затем дважды отмывали клетки от солей дистиллированной водой и снова центрифугировали. Отмытые клетки переносили в бюксы, предварительно доведенные до постоянного веса. Бюксы сушили при температуре 90о С в сушильном шкафу в течение 24 ч, охлаждали в эксикаторе и взвешивали на весах Adventure Ohaus. Биомассу бактерий определяли, как разницу между весом бюкса с клетками и весом чистого бюкса.
Вес пустого бюкса – 19.2034 г. Вес бюкса с биомассой – 19.2935 г. Биомасса в культуре – 4.5 г/л.
Определение концентрации фруктозы:
Концентрацию фруктозы определяли резорциновым методом. Для этого супернатант разводили в 25 раз. Из разведения 1 мл пробы наливали в пробирку, куда добавляли: 1 мл спиртового раствора резорцина (1 г резорцина растворяли в 100 мл 95%-го этилового спирта); 3 мл 80%-го раствора соляной кислоты. В качестве контроля брали: 1 мл дистиллированной воды, 1 мл спиртового раствора резорцина, 3 мл 30%-го раствора соляной кислоты. Пробирки с контролем и пробой помещали на водяную баню на 20 мин., при t=80oC. По истечении этого времени пробирки охлаждали до комнатной температуры и измеряли оптическую плотность на фотоколориметре Unico при λ=540 нм (длина оптического пути 5 мм).
Начальная концентрация фруктозы – 20 г/л. Конечная концентрация фруктозы – 7.58 г/л.
Определение содержания аммонийного азота:
Для определения содержания аммонийного азота к 10 мл дистиллированной воды добавляли 1 мл фугата, каплю щелочи (33%-го раствора КОН) и 0,5 мл реактива Несслера. В результате полученный раствор изменял свой цвет в зависимости от содержания азота. Окраску сравнивали со стандартом.
Начальная концентрация азота – 1.5 г/л. Конечная концентрация азота – 0.2 г/л.
Определение содержание в клетках ПГА:
Внутриклеточную концентрацию и состав ПГА определяли хроматографией метиловых эфиров жирных кислот после предварительного метанолиза образцов (навеска 3,9-4,5 мг) на хромато-масс-спектрометре GCD plus (“Hewlett Packard”, USA). Метанолиз проб полимера проводили следующим образом: к навеске сухой биомассы (3,9-4,5 мг) добавляли 1 мл внутреннего стандарта (0,5 мг бензойной кислоты/1 мл хлороформа), 0,85 мл метанола и 0,15 мл концентрированной серной кислоты и кипятили с обратными холодильниками в течение 2 часов 40 минут. По окончании метанолиза в колбу добавляли 1 мл дистиллированной воды.
Данные с хроматографа: Пик 1: 16673186 Пик 2: 56964786 Навеска: 4.5 мг Процентное содержание полимера в биомассе: 29.26%
Расчётные данные:
Удельная скорость роста по биомассе: ln (4.5) – ln (0.1) / 24 = 0.1585 Удельная скорость роста по фруктозе: ln (20) – ln (7.58) / 24 = 0.0404 Удельная скорость роста по азоту: ln (1.5) – ln (0.2) / 24 = 0.0839 Экономический коэффициент по фруктозе: (4.5 – 0.1) / (20 – 7.58) = 0.35 Концентрация полимера г/л: 4.5 * 0. 2926 = 1.305 г/л
Графики:
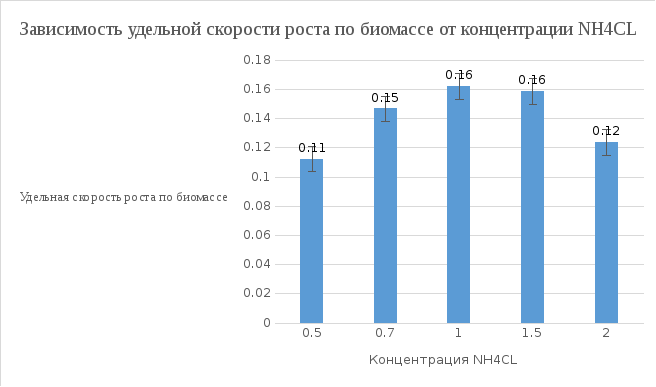
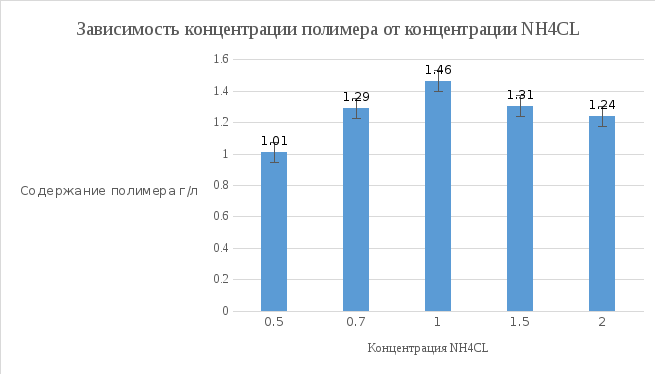
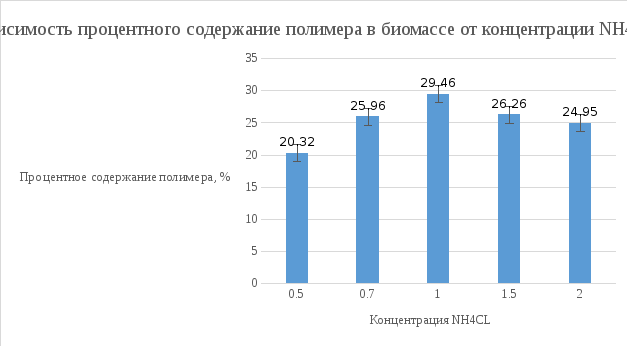
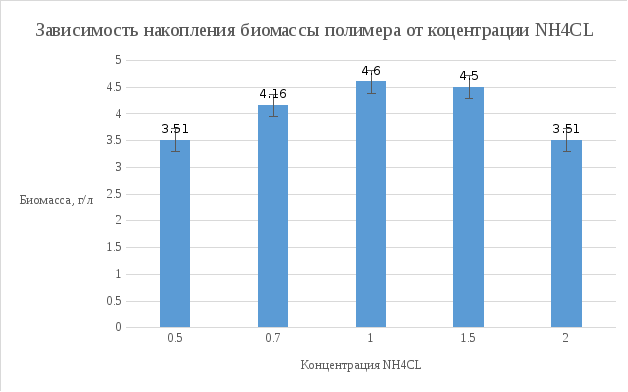
Вывод: Наиболее оптимальной концентрацией NH4CL для роста культуры является концентраций 1 г/л, при этой концентрации наблюдается наибольшая скорость роста, накопление биомассы и полимера в клетках микроорганизмов.
