- •Глава 2. Химическая термодинамика
- •1.Определение химическое термодинамики, термодинамическая система. Классификация систем. Понятие фазы.
- •2. Состояние системы. Параметры состояния, термодинамический процесс, функция состояния.
- •6.Стандартные условия. Стандартное состояние вещества. Стандартные энтальпии реакции и образования соединения.
- •Следствия:
- •17 Энергия Гиббса - это часть энергетического эффекта реакции, которую можно превратить в работу, поэтому ее называют свободной энергией.
6.Стандартные условия. Стандартное состояние вещества. Стандартные энтальпии реакции и образования соединения.
Стандартные условия — значения температуры и давления, при которых определяются (или к которым приводятся) значения различных количественных характеристик веществ, зависящих от давления и температуры (например, электродные потенциалы, скорости звукаи т. д.).
Станда́ртные состоя́ния — в химической термодинамике условно принятые состояния индивидуальных веществ и компонентов растворов при оценке термодинамических величин. Необходимость введения «стандартных состояний» связана с тем, что термодинамические закономерности не описывают достаточно точно поведение реальных веществ, когда количественной характеристикой служит давление или концентрация. Стандартные состояния выбирают из соображений удобства расчётов, и они могут меняться при переходе от одной задачи к другой. Стандартные энтальпии реакции – измеренный тепловой эффект реакции.
Стандартная
энтальпия образования
- обозначается ΔHfO.
Здесь индекс f означает formation (образование),
а перечеркнутый кружок, напоминающий
диск Плимсоля[1] —
то, что величина относится к стандартному
состоянию вещества.
В литературе часто встречается другое
обозначение стандартной энтальпии
— ΔH298,150,
где 0 указывает на равенство давления
одной атмосфере[2] (или,
несколько более точно, на стандартные
условия[3]),
а 298,15 — температура. Иногда индекс 0
используют для величин, относящихся
к чистому
веществу,
оговаривая, что обозначать им стандартные
термодинамические величины можно только
тогда, когда в качестве стандартного
состояния выбрано именно чистое
вещество[4].
Стандартным также может быть принято,
например, состояние вещества в предельно
разбавленномрастворе.
«Диск Плимсоля» в таком случае означает
собственно стандартное состояние
вещества, независимо от его выбора.
7. Закон Гесса. Следствия закона.
Закон Гесса - Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое
Следствия:
Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций с учетом их стехиометрических коэффициентов.
Энтальпия реакции равна разности сумм энтальпий сгорания начальных и конечных реагентов с учетом их стехиометрических коэффициентов.
Энтальпия реакции равна разности сумм энергий связей Eсв исходных и конечных реагентов с учетом их стехиометрических коэффициентов.
Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.
Энтальпия гидратации равна разности энтальпий растворения безводной соли
 и
кристаллогидрата
и
кристаллогидрата 
8. Самопроизвольный процесс. Постулат Клаузиуса.
Самопроизвольный процесс – процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве, пропорциональном произошедшему изменению состояния системы. Самопроизвольный процесс может протекать или обратимо, или необратимо. Хотя определение обратимого процесса уже приводилось, следует подробнее рассмотреть это понятие. Чтобы самопроизвольный процесс протекал обратимо, необходимо приложить извне такое сопротивление, чтобы переход был очень медленным и при бесконечно малом изменении противодействующей силы процесс мог пойти в обратном направлении. В случае обратимо происходящего изменения состояния системы производится максимальное количество работы. Всякий реальный процесс в какой-то степени является необратимым, и получаемая работа меньше максимально возможного теоретического количества.
Постулат Клаузиуса – тело не может переходить само собой от более холодного к более горячему
9. Энтропия – термодинамическая функция, которая служит мерой неупорядоченности состояния системы; свойство присущее любой системе, любому веществу, также как масса или объем; мера хаотичного движения в системе, мера ее беспорядка. Измеряется в энтропийных единицах, размерность Дж/мольК.
 Изменение
энтропии определяется отношением
количества теплоты, полученной/отданной
системой при температуре Т, к температуре:
Изменение
энтропии определяется отношением
количества теплоты, полученной/отданной
системой при температуре Т, к температуре:
∆S=S2-S1=Q/T
Термодинамическая вероятность (W)- число микросостояний ,с помощью которых осуществляется микросостояние.
 Уравнение
Больцмана:
Уравнение
Больцмана:
S=klnW =>
энтропия тем больше, чем больше число микросостояний, в которых может существовать данная система. Это уравнение придает физический смысл понятию энтропии.
 Физический
смысл энтропии (пример):
Беспорядок в системе обусловлен хаотичным
движением(поступательным, колебательным,
вращательным) ее частей. Поэтому в ряду
O<O2<O3
энтропия возрастает.
Физический
смысл энтропии (пример):
Беспорядок в системе обусловлен хаотичным
движением(поступательным, колебательным,
вращательным) ее частей. Поэтому в ряду
O<O2<O3
энтропия возрастает.
10. Изменение энтропии вещества с ростом температуры:
Энтропия возрастает во всех процессах, сопровождающихся увеличением беспорядка, т.е. при нагревании ( измельчении, увеличении объема, плавлении, растворении и т.д.)
 Изменение
энтропии в химических реакциях:
Изменение
энтропии в химических реакциях:
∆S0вммчс
р(298 К)= сумма∆ S0(298 K)(продуктов)- сумма∆ S0(298 K)(исходных веществ)
коэффициенты перед веществами не забудьте!!(домножить на них нужно∆ S0 )
В закрытой системе при Р, Т = const Qp=∆H,=> T∆S>∆H, ∆H-T∆S<0
11. Второй закон термодинамики.
Постулат Клаузиуса: «Теплота не может переходить сама собой от более холодного тела к более горячему»
2 закон «на новый лад»: «В изолированной системе ∆S=0 для обратимых процессов и ∆S>0 для самопроизвольных».
Для изолированной системы(Q=0):
∆ S =0 для обратимых процессов и ∆ S >0 для самопроизвольных (необратимых) процессов. Это неравенство является математическим выражением второго закона термодинамики:
 в
изолированной системе самопроизвольно
протекают те процессы, в которых энтропия
возрастает.
в
изолированной системе самопроизвольно
протекают те процессы, в которых энтропия
возрастает.
Для закрытой системы (Q=0): ∆S=S2-S1=Q/T или T∆S=Q. Это неравенство является математическим выражением второго закона термодинамики:
В закрытой системе самопроизвольно могут протекать процессы и с увеличением и с уменьшением энтропии, лишь бы T∆S>Q.
12. Третий закон термодинамики
Постулат Планка: «При абсолютном нуле энтропия идеального кристалла равна нулю».
 Стандартная
энтропия вещества-
значения энтропии веществ в стандартном
состоянии. Поскольку стандартным
состоянием считается состояние системы
при 298 К и 1 атм, то при изменении энтропии
при переходе от 0 К до 298 К равно:
Стандартная
энтропия вещества-
значения энтропии веществ в стандартном
состоянии. Поскольку стандартным
состоянием считается состояние системы
при 298 К и 1 атм, то при изменении энтропии
при переходе от 0 К до 298 К равно:
∆ S=S(298 K)-S(0 K)=S(298 K)- 0= S0 (298 K)
13. Энтальпийный и энтропийный факторы химической реакции
Энтальпийный фактор -> ∆H-отражает стремление системы перейти в состояние с наименьшей энергией,с выделением ее части в форме теплоты и работы.
 Энтропийный
фактор->
T∆S-характеризует
противоположную тенденцию- стремление
атомов к наиболее беспорядочному
расположению.
Энтропийный
фактор->
T∆S-характеризует
противоположную тенденцию- стремление
атомов к наиболее беспорядочному
расположению.
 14,15
Свободная
энергия Гиббса (G)
-функция состояния( H-TS=G);
14,15
Свободная
энергия Гиббса (G)
-функция состояния( H-TS=G);
∆Gр(T)=∆Н0вммчс
р(298 К)-Т∆S0вммчс р(298 К)
 ∆G0вммчс
∆G0вммчс
р(298 К)= сумма ∆ G0(298 K)(продуктов)- сумма ∆ G0(298 K)(исходных веществ)
коэффициенты перед веществами не забудьте!!(домножить на них нужно∆ G0 )
∆G<0 –неравенство, которое является критерием самопроизвольного протекания химической реакции в закрытой системе(при P,T=const)
∆G>0 => самопроизвольно идет обратная реакция
∆G=0 => система находится в равновесии и никакая реакция не идет
Для определения температуры,выше которой происходит смена знака энергии Гиббса реакции,можно воспользоваться условием:
Тр = ∆Н/вммчс
∆ S
Тр- температура, при которой устанавливается равновесие, т.е. равновероятная возможность протекания прямой и обратной реакций
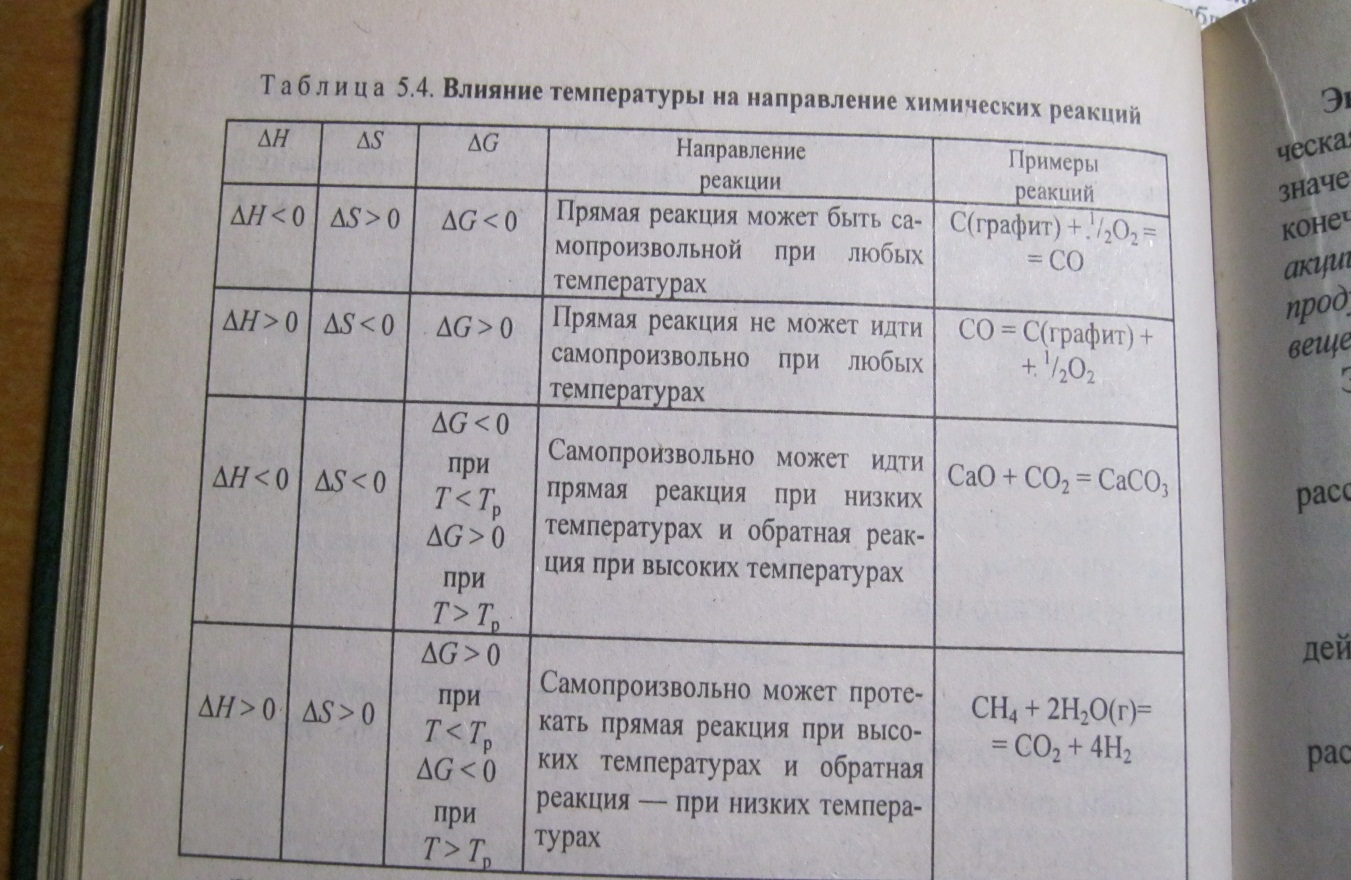
 16
∆H<0 (экзотермическая реакция),∆S>0
=> прямая реакция, ∆G<0 при любой
температуре
16
∆H<0 (экзотермическая реакция),∆S>0
=> прямая реакция, ∆G<0 при любой
температуре
 ∆H>0
(эндотермическая реакция),∆S<0
=>произвольно не может
∆H>0
(эндотермическая реакция),∆S<0
=>произвольно не может
протекать прямая реакция при любой температуре, т.к ∆G>0
∆H<0(экзотермическая реакция),∆S<0,то |∆H|>|T∆S| и реакция может самопроизвольно протекать в прямом направлении, ∆G<0. При высоких температурах |∆H|<|T∆S| прямая реакция самопроизвольно протекать не может (∆G>0),а обратная реакция возможна.
∆H>0(эндотермическая реакция),∆S>0,при невысоких температурах, когда |∆H|>|T∆S|, самопроизвольно прямая реакция идти не может(∆G>0).При высоких температурах Т>Tp=∆H/∆S, когда |∆H|<|T∆S|, прямая реакция может протекать самопроизвольно (∆G<0).