
- •Химическая кинетика.
- •Понятие скорости гомогенной реакции.
- •Зависимость скорости реакции от концентрации реагентов. Закон действующих масс, константа скорости реакции. Кинетическое уравнение гетерогенной реакции (пример).
- •3.Гетерогенная реакция, ее стадии. Кинетическое уравнение гетерогенной реакции. (пример).
- •4.Завасимость скорости реакции от температуры. Правило Ван-Гоффа.
- •5.Понятие энергии активации. Распределение Максвелла – Больцмана. Уравнение Аррениуса. Предэкспоненциальный множитель. Энергетическая диаграмма химической реакции.
- •7.Поняти простой и сложной реакции.(пример). Молекулярность реакции. (пример). Механизм реакции.(пример). Понятие лимитирующее стадии.
7.Поняти простой и сложной реакции.(пример). Молекулярность реакции. (пример). Механизм реакции.(пример). Понятие лимитирующее стадии.
Совокупность стадий, через которые протекает химическая реакция называется механизмом реакции. Синтез HI включает две стадии:
1. Образование АК. При этом затрачивается энергия. ∆Е = 198 кДж/моль.
2. Распад АК на две молекулы HI . При этом выделяется энергия. ∆Е = -171 кДж/моль.
Первая стадия менее выгодна по энергии, значит менее вероятна и идет с меньшей скоростью. Скорость сложного процесса будет определяться самой медленной стадией, которая называется лимитирующей. Поэтому подбирают такие способы получения вещества, чтобы их скорость была максимальна. Одним из таких способов является использование катализаторов.
Все реакции можно подразделить на простые и сложные. Простые реакции протекают в одну стадию и называются одностадийными. Сложные реакции идут либо последовательно (многостадийные реакции), либо параллельно, либо последовательно—параллельно. В свою очередь, в каждой стадии реакции может участвовать одна молекула (мономолекулярные реакции), две молекулы (бимолекулярные реакции) и три молекулы (тримолекулярные реакции).
Число молекул реагента, принимающих участие в простейшей (элементарной) стадии, называется ее молекулярностью.
Одностадийные реакции. Относительно небольшое число реакций протекает в одну стадию. К одностадийным реакциям, например,
относятся:
реакции диссоциации
Н2
 2Н,
С12
2С1, 2HI
Н2
+l2.
2Н,
С12
2С1, 2HI
Н2
+l2.
взаимодействие иода и водорода
I + Н2 2HI
взаимодействие моноксида азота с водородом и озоном
2NO + Н2 N20 + Н20
NO
+ O3 =
N0 + 0
+ 0
Сложные реакции. К сложным относятся реакции, протекающие последовательно через несколько стадий, или параллельно. Большинство реакций являются многостадийными.
Если одна из этих стадий протекает значительно медленнее других, то эта стадия будет определять скорость всего процесса, и ее называют лимитирующей стадией.
Обычно лимитирующая стадия записывается как необратимая реакция, а другие стадии как обратимые реакции. Например:
N2O2 ↔NO2 + NO3 (быстрая реакция)
NO2 + NO3 → NO2 + NO + O2 (медленная реакция)
NO + NO3 ↔ 2NO2 (быстрая стадия)
Лимитирующая вторая стадия.
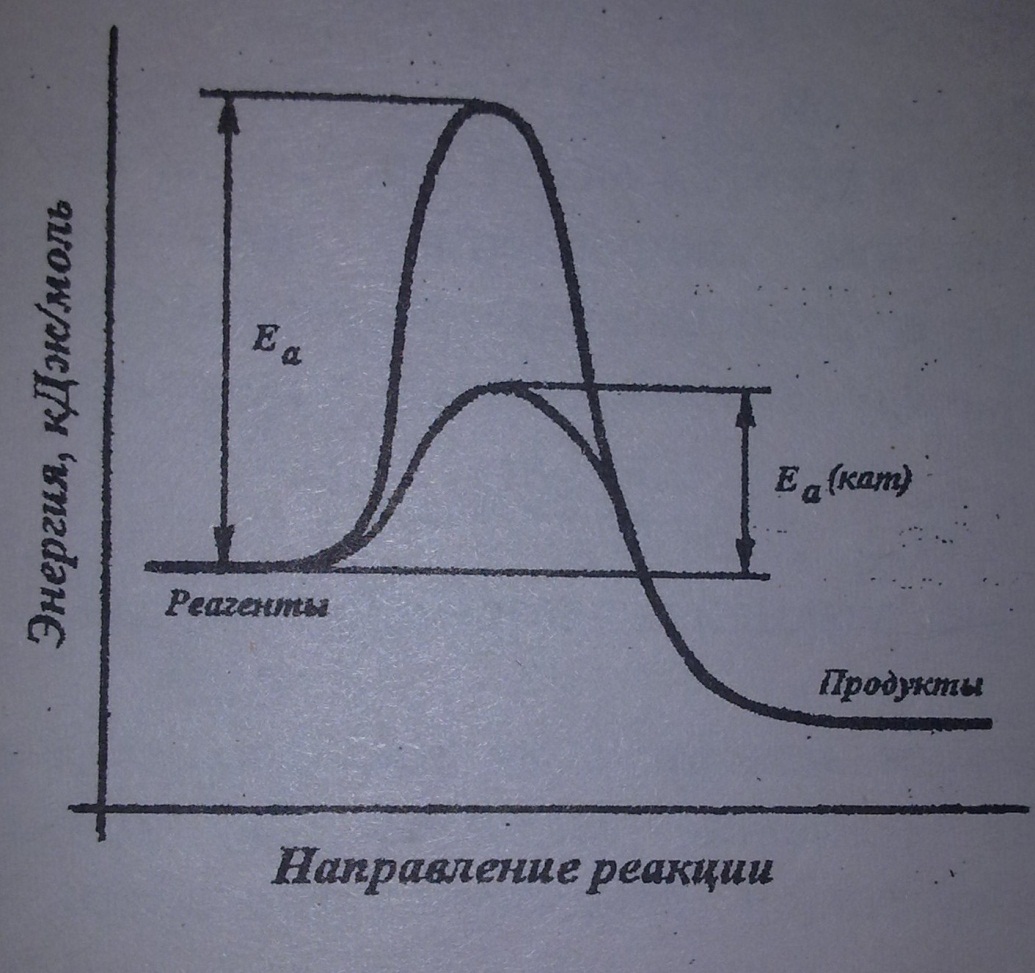
8) Катализом называется явление изменения скорости реакции под действием некоторых веществ (катализаторами) и не входящими в стехиометрическое уравнение реакции, которые участвуют в процессе, но к концу реакции остаются неизменными. Катализ называется положительным, если скорость реакции увеличивается и отрицательным, если уменьшается, при добавлении катализатора. В присутствии катализатора образуется другой АК (активированный комплекс) с меньшей ЕА ( энергия активации реакции) и реакция ускоряется.
Св-ва катализатора:
-Катализатор ускоряет только термодинамически возможные реакции
-Катализатор в ходе реакции сохраняет количество и химический состав, но не физическое состояние
-В равной степени ускоряет прямую и обратную реакции, следовательно не смещает равновесие
-Разные катализаторы с одним и теми же исходными веществами образуют разные АК, значит могут образовывать разные продукты реакции, это свойство называется- селективностью катализатора.
9). При гомогенном катализе молекулы реагирующих веществ и катализатора находятся в одной фазе (жидкой или газооб.), в которой образуют АК.
10). При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Энергетическая диаграмма (одна для обоих катализов)
11).Обратимые и необратимые химические реакции:
Реакции, которые в любых условиях самопроизвольно протекают в одном направлении, называются необратимыми
2KClO 3 = 2KCl + 3O 2 ↑
Реакции, которые при одной и той же температуре, в зависимости от соотношения реагентов могут протекать, как в прямом, так и в обратном направлении, называются обратимыми. Знак равенства в уравнении меняется на ⇌
3H2 + N2 ⇌ 2NH3.
Большинство химических реакций является обратимыми.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ – состояние химической системы, при котором возможны реакции, идущие с равными скоростями в противоположных направлениях. При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем.

12). Константа химического равновесия — количественная характеристика химического равновесия
Константа химического равновесия определяется по закону действующих масс. Ее значения находят расчетно или на основании экспериментальных данных. Константа химического равновесия зависит от природы реагентов и от температуры.
Гетерогенная реакция(для газов):
Кс=[D]m/[A]n*[B]m
2ZnS(тв)+3O2(г) ⇌2ZnO(тв)+2SO2(г)
Кс=[SO2]2m/[O2]3
Гомогенная реакция:
Kc=[C]n*[D]m/[A]n*[B]m
Парциа́льное давление)— давление отдельно взятого компонента газовой
Смеси
Кр=рm(С)*рn(D)/ pm(A)*pn(B)
Pобщ=сумма Pi
Pi=CiRT- уравн-ие Клаперона-Менделеева
Pi-парциальное давление
Kp=Kc(RT)∆V
∆V=C+d-a-b
C+d=a+b => Kc=Kp
13) Связь Кс и свободной энергии Гиббса:
∆G0p=-RTlnKp
Kp=ln-∆ Gp/RT
![]()
Это уравнение называют уравнением изотермы химической реакции. Оно позволяет рассчитать изменение энергии Гиббса при протекании процесса и определить направление протекания реакции:
при ![]()
![]() —
реакция идёт в прямом направлении, слева
направо;
—
реакция идёт в прямом направлении, слева
направо;
при ![]()
![]() —
реакция достигла равновесного состояния;
—
реакция достигла равновесного состояния;
при ![]()
![]() —
реакция идёт в обратном направлении.
—
реакция идёт в обратном направлении.
Влияние Т на К равновесия:
∆G0p=-RTlnKp
lnKp=-∆G0p/RT=-∆H0p/RT+∆S0p/R
Для экзотермической реакции (∆H<0), константа равновесия уменьшается с повышением температуры
Для экзотермической реакции (∆H>0), константа равновессия повышается с повышением температуры
14) Смещение химического равновесия
Хим. Равновесие можно сместить, если непрерывно выводить из реакционной смеси продукты реакции за счёт образования осадка или выделения газа
Принцып Ле-Шателье: если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо внешнее воздействие, то равновесия сместится так, чтобы уменьшить эффект оказываемого воздействия.
Влияние температуры:
Повышение температуры вызывает смещение равновесия в том в направлении эндотермической реакции. Напротив, понижение температуры способствует протеканию экзотермической реакции.
Влияние давления:
Повышение давления смещает равновесие в направлении реакции, которая ведёт к уменьшению объёма системы.
Влияние концетраций:
Равновесие сместится в направлении прямой реакции (в сторону образования продукта).
Влияние катализатора:
Не влияет на Кс, т.к. в одинаковой степени ускоряет и прямую и обратную реакции.
