
- •Химическая кинетика.
- •Понятие скорости гомогенной реакции.
- •Зависимость скорости реакции от концентрации реагентов. Закон действующих масс, константа скорости реакции. Кинетическое уравнение гетерогенной реакции (пример).
- •3.Гетерогенная реакция, ее стадии. Кинетическое уравнение гетерогенной реакции. (пример).
- •4.Завасимость скорости реакции от температуры. Правило Ван-Гоффа.
- •5.Понятие энергии активации. Распределение Максвелла – Больцмана. Уравнение Аррениуса. Предэкспоненциальный множитель. Энергетическая диаграмма химической реакции.
- •7.Поняти простой и сложной реакции.(пример). Молекулярность реакции. (пример). Механизм реакции.(пример). Понятие лимитирующее стадии.
Химическая кинетика.
Понятие скорости гомогенной реакции.
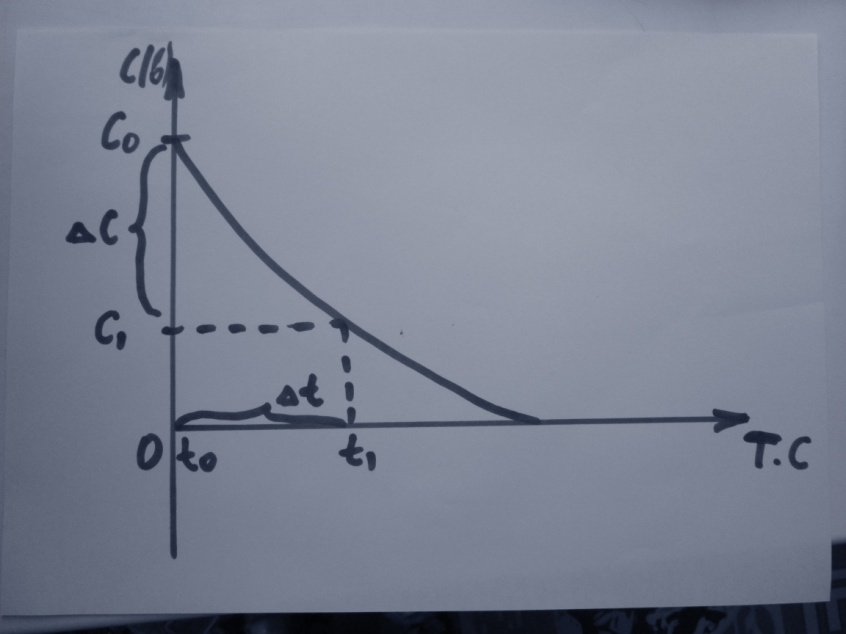
Общее понятие: Скорость химической реакции – изменение количества вещества в единицу времени.
В зависимости от химической реакции меняется характер реакционного пространства.
Гомогенной реакцией называется реакция, протекающая в однородной среде (в одной фазе).
Реакционным пространством гомогенных реакций является объем, заполненный реагентами. Так как отношение количества вещества к единице объема называется концентрацией «С», то скорость гомогенной реакции равна изменению концентрации исходных веществ или продуктов реакции во времени.
С (в)= n (в)/ V - молярная концентрация в-ва.
U0
=
 =
=

 скорость
реакции.
скорость
реакции.
Знак (+) относится к изменению концентрации продуктов реакции, знак (-) - к изменению концентрации реагентов.
Зависимость скорости реакции от концентрации реагентов. Закон действующих масс, константа скорости реакции. Кинетическое уравнение гетерогенной реакции (пример).
Зависимость скорости реакции от концентрации реагентов выражается законом действующих масс: скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степень их стехиометрических коэффициентов.
mA+nB=AmBn
Vпр = kпрC(A)m*C(B)n Vобр= kобрС(AmBn)
Где k – константа скорости реакции. Численно k равна скорости данной реакции при концентрации веществ, равных 1 моль/л. k= constдля данной реакции. k = 10-8 – 10-1 – медленные реакции; k=101 – 1011 – быстрые реакции.
Уравнение, связывающее скорость химической реакции с концентрацией вещества называется кинетическим уравнением.
Сумма показателей степени (n+m) называется порядком реакции (n).
Порядок реакции зависит от ее сложности. Если реакция простая, т.е. протекает в одну стадию, то порядок реакции равен сумме стехиометрических коэффициентов .
Закон действующих масс для прямой гомогенной реакции,

протекающей
слева направо в однородной среде (смесь
газов, раствор) ( ),
имеет вид:
),
имеет вид:

 ,
,
 – реагенты – вещества, вступающие в
реакцию;
– реагенты – вещества, вступающие в
реакцию;
 ,
,
 – продукты – вещества, образующиеся в
результате реакции;
– продукты – вещества, образующиеся в
результате реакции;
 ,
,
 ,
,
 ,
,
 – стехиометрические коэффициенты,
показывающие, какое количество
соответствующего вещества участвует
в реакции.
– стехиометрические коэффициенты,
показывающие, какое количество
соответствующего вещества участвует
в реакции.
Для гетерогенной реакции, протекающей на границе раздела фаз (твердой и жидкой, твердой и газообразной) концентрации веществ, находящихся в конденсированном состоянии, постоянны и включаются в константу скорости реакции. Тогда для прямой реакции
 ,
,
если вещество твердое, закон действующих масс запишется:

Для обратимых химических реакций, которые могут протекать как в прямом, так и в обратном направлениях, скорости реакции запишутся:
Вид реакции |
скорость реакции |
|
прямой ( ) |
обратной
( |
|
Гомогенная |
|
|
Гетерогенная: вещества и твердые или жидкие |
|
|
 –
константы
скоростей прямой и обратной реакций,
соответственно. Физический смысл
константы скорости: при концентрации
всех реагирующих веществ, равных 1
моль/л, константа скорости равна скорости
реакции.
–
константы
скоростей прямой и обратной реакций,
соответственно. Физический смысл
константы скорости: при концентрации
всех реагирующих веществ, равных 1
моль/л, константа скорости равна скорости
реакции.
Константа скорости реакции зависит от природы реагирующих веществ, температуры и присутствия катализатора. Для каждой реакции при постоянной температуре константа скорости величина постоянная.
Используя
закон действующих масс, можно определить,
как будет изменяться скорость реакции
при изменении параметров системы:
 ,
,
 ,
,
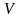 .
.

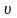 )
)

