
- •Кинетика гетерогенных процессов
- •Многостадийность гетерогенных реакций.
- •Кинетика в переходной области.
- •Коэффициент диффузии
- •Механизмы каталитической реакции.
- •Гомогенно-каталитические реакции
- •Гетерогенный катализ
- •2. Изотерма адсорбции Ленгмюра.
- •3. Кинетика мономолекулярной реакции.
- •4. Кинетика бимолекулярной реакции.
- •Фотохимические реакции
- •Закон Штарка-Энштейна (1912г.)
- •Закон Ламберта-Беера,
- •Полный квантовый выход
- •Квантовый выход первичной фотохимической реакции.
- •Функция от интенсивности падающего света:
- •Цепные реакции
Фотохимические реакции
Определение фотохимической реакции
Фотохимическими
называют химические реакции,
протекающие под воздействием облучения
реакционной смеси видимым или
ультрафиолетовым светом (![]() ,
фотолиз).
,
фотолиз).
Действие света заключается в том, что молекулы реагентов, поглощая свет переходят в возбужденное энергетическое состояние и потому обладают повышенной реакционной способностью.
Стадии фотохимической реакции.
1. Фотохимическая реакция - многостадийный физикохимический процесс, в котором, обычно, выделяют 2 основных этапа:
а) Первичный фотохимический процесс - процесс, к которому относят акт поглощения кванта света с непосредственно сопровождающими его физико-химическими процессами.
б) Вторичные химические реакции – реакции, которые не требуют для своего протекания электромагнитного облучения, но являющиеся следствием этого облучения.
2. Первичный фотохимический процесс (выделяют 2 стадии):
а) Начальный
акт поглощения
- взаимодействие молекулы с квантом
света, в результате которого она переходит
в электронно-возбужденное состояние:
![]()
б) Первичные фотохимические превращения
1) химические – взаимодействие с другими молекулами
![]()
внутримолекулярные
превращения
![]()
фотодиссоциация на атомы или радикалы
![]() и др.
и др.
физические – дезактивация при столкновении со стенкой
или нейтральной молекулой
![]() ,
,
![]()
флуоресценция
![]() и др.
и др.
3. Вторичные (темновые) процессы
а) продукты первичных превращений – нейтральные молекулы
б) – активные частицы (атомы или радикалы)
а)
![]()
б)
![]()
![]() и т.д.
и т.д.
Основные законы фотохимии.
Закон Гротгуса-Дрепера.
Только поглощаемое средой излучение способно вызвать в ней химическое изменение.
Закон Штарка-Энштейна (1912г.)
Каждый поглощенный квант света способен в первичном фотохимическом акте активизировать только одну молекулу, т.е. вызвать химическое превращение одной молекулы.
Закон Ламберта-Беера,
Квантовый выход фотохимической реакции.
Полный квантовый выход
а) Квантовый выход – отношение числа прореагировавших молекул к числу поглощенных квантов света.
![]()
![]()
![]()
б) Пределы изменения квантового выхода.
1)
![]() выполняется закон Эйнштейна
выполняется закон Эйнштейна
2)
![]() физическая дезактивация, отсутствие
вторичных процессов (низкие
физическая дезактивация, отсутствие
вторичных процессов (низкие
![]() )
)
 а)
а)
 ,
,

![]()
![]()
![]()
![]() б) цепной механизм
реакции
б) цепной механизм
реакции
Квантовый выход первичной фотохимической реакции.
отношение числа прореагировавших возбужденных молекул в акте первичного фотохимического превращения к числу поглощенных квантов света
 .
.
Кинетика фотохимической реакции
Скорость реакции,


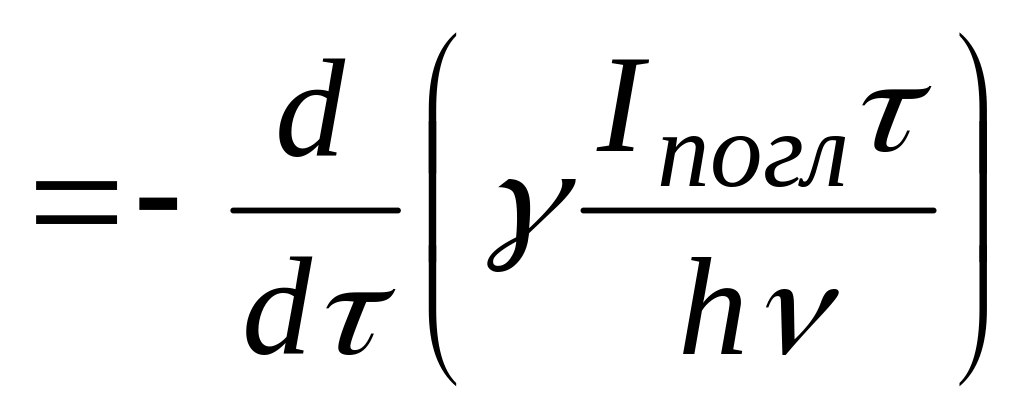


Закон Ламберта-Беера,

3.
![]() ,
,
![]()
![]()
![]()
![]()
а)
![]()
![]() ,
,
![]()
б)
![]()
![]() ,
,
Сенсибилизированные фотохимические реакции.
Сенсибилизация – придание несветочувствительным веществам способности к фотохимическим превращениям.
Сенсибилизаторы – вещества, которые непосредственного участия в химическом процессе не принимают, но поглощают кванты света и передают проглощенную энергию реагентам, которые и испытывают затем химическое превращение.
Пример: фотохим. разложение
 в
присутствии паров
в
присутствии паров
 .
.
а)
![]()
б)
![]()
![]()
Основные различия фотохимических реакций и
реакций с термическим возбуждением.
