
- •Кинетика гетерогенных процессов
- •Многостадийность гетерогенных реакций.
- •Кинетика в переходной области.
- •Коэффициент диффузии
- •Механизмы каталитической реакции.
- •Гомогенно-каталитические реакции
- •Гетерогенный катализ
- •2. Изотерма адсорбции Ленгмюра.
- •3. Кинетика мономолекулярной реакции.
- •4. Кинетика бимолекулярной реакции.
- •Фотохимические реакции
- •Закон Штарка-Энштейна (1912г.)
- •Закон Ламберта-Беера,
- •Полный квантовый выход
- •Квантовый выход первичной фотохимической реакции.
- •Функция от интенсивности падающего света:
- •Цепные реакции
Гетерогенный катализ
Гетерогенно-каталитические реакции.
Понятие – процессы, протекающие на границе раздела фаз, одной из которых служит катализатор.
Гетерогенно-каталитические реакции заметно более распространены в промышленности, чем реакции гомогенного катализа. Наибольшее практическое значение получили гетерогенно-каталитические процессы на твердых катализаторах, что обусловлено удобством отделения твердого катализатора от газообразных и жидких реагентов.
Типы катализаторов.
В зависимости от физического состояния твердые катализаторы подразделяют на порошковые (зернистые), нанесенные (адсорбционные) и скелетные.
Зернистые катализаторы.
представляют собой измельченные твердые тела, применяемые обычно в цилиндрической форме или в виде сферических гранул размером в несколько миллиметров.
2. Нанесенные адсорбционные катализаторы
обычно готовят нанесением активного агента (например,
 )
на пористый инертный носитель с
высокоразвитой поверхностью. Обычно
это делают посредством пропитки
активированного угля, силикагеля,
алюмосиликатов и др. пористых веществ
растворами солей металлов с последующей
просушкой и термической обработкой
или восстановлением водородом.
)
на пористый инертный носитель с
высокоразвитой поверхностью. Обычно
это делают посредством пропитки
активированного угля, силикагеля,
алюмосиликатов и др. пористых веществ
растворами солей металлов с последующей
просушкой и термической обработкой
или восстановлением водородом.
3. Скелетные катализаторы.
готовят путем сплавления порошков металлов
 с алюминием и последующим растворением
(выщелачиванием) последнего в щелочи.
Остается «скелет», обладающий высокой
пористостью и удельной поверхностью.
с алюминием и последующим растворением
(выщелачиванием) последнего в щелочи.
Остается «скелет», обладающий высокой
пористостью и удельной поверхностью.
Кинетика гетерогенно-каталитических реакций
1. Закон действующих поверхностей
Химическое взаимодействие в гетерогенно-каталитическом процессе происходит между адсорбированными молекулами реагентов, как говорят, в адсорбционном слое. Тогда скорость реакции будет зависеть не от объемной, но от поверхностной концентрации реагирующих веществ, т.е. от величин адсорбции.
Скорость
гетерогенно-каталитической реакции
пропорциональна произведению величин
адсорбции (степеней заполнения) каждого
из реагентов, т.е.
![]()
2. Изотерма адсорбции Ленгмюра.
Связь между
поверхностной и объемной концентрацией
реагирующего вещества устанавливается
изотермой адсорбции. Если принять, что
поверхность катализатора энергетически
однородна, т.е.
![]() ,
то величина адсорбции описывается
уравнением Ленгмюра:
,
то величина адсорбции описывается
уравнением Ленгмюра:
![]() или
или
![]() ,
,
![]() .
.
3. Кинетика мономолекулярной реакции.
![]() ,
,
![]()
а)
![]()
![]()
б)
![]()
![]() , т.о.
, т.о.
![]()
4. Кинетика бимолекулярной реакции.
![]() .
.
а)
![]()
![]()
б)
![]() , т.о.
, т.о.
![]()
Кинетика реакций в растворах . Уравнение Бренстеда – Бьеррума.
Клеточный эффект
Молекулы растворённого вещества совершают нерегулярные колебания с периодом τ 0 в “клетке”, образованной соседними молекулами растворителя. Поколебавшись около одного положения равновесия в течение некоторого времени τ , частица перескакивает в соседнюю клетку, для чего она должна иметь энергию, большую некоторого порогового значения E. В рамках клеточной модели механизм жидкофазной реакции выглядит следующим образом: каждая из частиц скачками, следующими друг за другом через время τ , беспорядочно перемещается в среде растворителя. В результате перемещений происходят случайные встречи частиц, то есть попадание их в одну клетку жидкости, с образованием диффузионной пары. В клетке частицы испытывают колебания с периодом τo , во время которых они претерпевают соударения с молекулами растворителя и между собой. Если за время τ частицы не успевают прореагировать, то диффузионная пара распадается, и частицы снова расходятся. Таким образом, необходимым условием жидкофазной реакции является предварительное попадание частиц в результате диффузии в одну клетку, где частицы и реагируют в соударениях.
Время пребывания в клетке обычно составляет 10–10 – 10–8с.
Влияние ионной силы на скорость реакции.
Уравнение Аррениуса справедливо и для реакций в растворах. В этом уравнении и во всех уравнениях химической кинетики фигурируют концентрации реагирующих веществ. В термодинамике же константа равновесия неидеальной системы выражается через активности. Это обстоятельство необходимо учитывать, если в кинетическое уравнение входит константа равновесия. Правда, при реакциях в газовой фазе и между нейтральными молекулами в растворе в этом нет практической необходимости, но при рассмотрении реакций между заряженными частицами подобное пренебрежение может явиться источником существенных ошибок. Для константы скорости бимолекулярной реакции
![]()
протекающей в растворе, теория активного комплекса дает
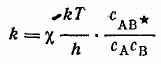
Т ермодинамическая
же константа равновесия между исходными
веществами
и активным комплексом
ермодинамическая
же константа равновесия между исходными
веществами
и активным комплексом
И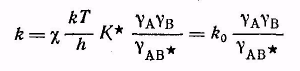 ,
комбинируя эти уравнения, получаем
,
комбинируя эти уравнения, получаем
Это уравнение Бренстеда-Бьеррума.
Оно справедливо для константы скорости реакции, протекающей в любой неидеальной среде. Величина k0 имеет смысл константы скорости при бесконечном разведении, т. е. при γ=1.
Д![]() ля
использования уравнения в конкретном
случае необходимо
задаться тем или другим аналитическим
выражением
для коэффициентов активности. Если в
качестве стандартного состояния выбрать
бесконечное разведение, теория
электролитов
дает следующее приближенное соотношение
для коэффициента
активности:
ля
использования уравнения в конкретном
случае необходимо
задаться тем или другим аналитическим
выражением
для коэффициентов активности. Если в
качестве стандартного состояния выбрать
бесконечное разведение, теория
электролитов
дает следующее приближенное соотношение
для коэффициента
активности:
Рассмотрим два случая:
1.
Взаимодействие между заряженными
частицами.
Д![]() ля
случая взаимодействия между
двумя ионами второй сомножитель мал, и
тогда
ля
случая взаимодействия между
двумя ионами второй сомножитель мал, и
тогда
Следовательно, логарифм константы скорости, согласно теории, должен быть линейной функцией корня квадратного из ионной силы, а тангенс угла наклона прямой определяется соотношением зарядов реагирующих частиц.
2. Взаимодействие между ионом и нейтральной молекулой: z = 0.
Согласно уравнению, коэффициент активности для нейтральной молекулы: γ=eβI
М![]() алость
величины β позволяет разложить экспоненту
в ряд, пренебрегая членами высших
степеней для не очень больших значений
I:
алость
величины β позволяет разложить экспоненту
в ряд, пренебрегая членами высших
степеней для не очень больших значений
I:
Следовательно, константа скорости пропорциональна ионной силе.
При рассмотрении р-ций в растворах следует учитывать, что, хотя число столкновений реагирующих частиц с растворителем очень много, эти столкновения увеличивают как скорость активации, так и скорость дезактивации. Поэтому в целом скорость реакции меняется мало – увеличивается или уменьшается до двух раз. НО есть исключения: типичный случай – реакция Меншуткина: R-X (Х – галоген) + N - (Ri)3 = X – N – (Ri)4 . Скорость этой реакции сильно зависит от растворителя. Очень малая часть соударений приводит к реакции – стерический множитель от 10-5 до 10-8. Причины – необходима специфическая ориентация при столкновении, имеется специфическое распределение энергии по внутренним степеням свободы.
