
Ээг при синдроме Ретта
Синдром Ретта- это тяжелое наследственное заболевание проявляющееся в нарушении развития нервной системы и поражающем, преимущественно, девочек в возрасте 6-18 мес. Синдром был впервые описан австрийским неврологом профессором Андриасом Реттом в 1966 году(Rett,1966). В 1983 году шведский ученый Бент Хегберг описал 35 случаев больных с этим синдромом, положив начало интенсивному исследованию этого заболевания (Hagberg, 1983). Частота встречаемости заболевания составляет 1: 10000 новорожденных девочек (Hagberg B Hagberg G., 1997). Заболевание характеризуется выраженной моторной дисфункцией, распадом высших психических функций, поведенческими нарушениями. Для этого синдрома характерна стадийность течения. Беременность и роды, как правило, протекают без осложнений. Короткий период времени ребенок может развиваться нормально. Первая стадия чрезвычайно трудна для диагностики. Вычленить ее удалось только благодаря анализу видеоматериалов, сохранившихся у родителей детей с РС. Удалось показать, что в среднем в период 3-9 месяцев жизни отмечается излишнее спокойствие детей, относительная малоподвижность, иногда сменяющаяся периодами повышенной активности, повышенная подчиняемость, снижение мышечного тонуса, трудности привлечения внимания; задержки роста головы, которая отмечается в возрасте 2-3 месяца. Эту стадию заболевания принято называть стадией остановки развития, хотя, дети и достигают к году уровня развития 9-12 месячного возраста. Эта стадия длится до начала периода регресса, который наступает в среднем в возрасте 9-30 месяцев жизни. Длительность этого периода от недель до нескольких месяцев. В это время дети теряют все сформированные к этому возрасту навыки, речь и способность пользоваться руками. Дети становятся аутистически отрешенными, не реагируют на обращение к ним, что в ряде случаев требует дифференцировать эти состояния с нарушением слуха, теряется болевая чувствительность
Появляются насильственные стереотипные движения, в основном, «моющего» характера, которые совершаются беспрерывно, прекращаясь только во сне. Задержка роста головы приводит к формированию микроцефалии, однако, отмечено уменьшение размеров также и внутренних органов, в т.ч., сердца. В это же время возникают расстройства дыхания в виде гипервентиляции, задержки дыхания и заглатывания воздуха. В этот период у 15-20 % детей возникают эпилептические приступы. После окончания периода регресса, в псевдостационарной стадии, уменьшаются аутистические проявления, улучшается контакт с окружающими, понимание речи, уменьшается выраженность и интенсивность моторных стереотипий. Появляется, правда, несколько отставленная, реакция, на обращенную речь. У небольшого числа детей возможно восстановление отдельных слогов и слов. Однако, неврологические нарушения медленно прогрессируют: появляется сколиоз, кифоз, мышечная гипотония сменяется повышением тонуса, появляется деформация нижних конечностей, более чем в 50% случаев отмечаются эпилептические приступы. Четвертая стадия СР характеризуется усилением спастичности, ригидности, появлением мышечных дистрофий. Больные перестают ходить, появляются нарушения жевания, глотания. В среднем у 80% детей с клиническими проявлениями синдромома обнаруживается мутация гена МеСР2. Синдром Ретта - первое описанное заболевание, связанное с дефектом белка, участвующего в метилировании ДНК и, следовательно, связанного с регуляцией транскрипции других генов. В настоящее время описано более 100 мутаций в гене MeСР2 и их число продолжает расти. Наиболее часто встречаются точечные мутации замены- нонсенс (48%) и миссенс (34 %) мутации. Все нонсенс мутации приводят к преждевременному прекращению трансляции за счет замены функционального кодона на стоп кодон, поэтому их также называют обрывающими мутациями (truncating mutations). Приблизительно в 2 раза реже встречаются делеции (выпадение), еще реже инсерции (вставки). Очень часто делеции и инсерции приводят к мутациям со сдвигом рамки считывания (frameshift mutations).
Нарушения ЭЭГ при этом синдроме были описаны уже в первой публикации A. Rett (1966). Описание изменений ЭЭГ можно классифицировать по трем основным разделам : общие изменения ЭЭГ и их корреляция со стадиями течения заболевания , эпилептические проявления в ЭЭГ, ЭЭГ нарушения сна у больных с этим синдромом. СР характеризуется стадийностью течения, поэтому были сделаны попытки сопоставить изменения ЭЭГ со стадиями течения заболевания. Так G. Bader (1993) отмечает, что в 1ой стадии СР ЭЭГ не отличается от нормы, отмечается лишь незначительное замедление фоновой активности.
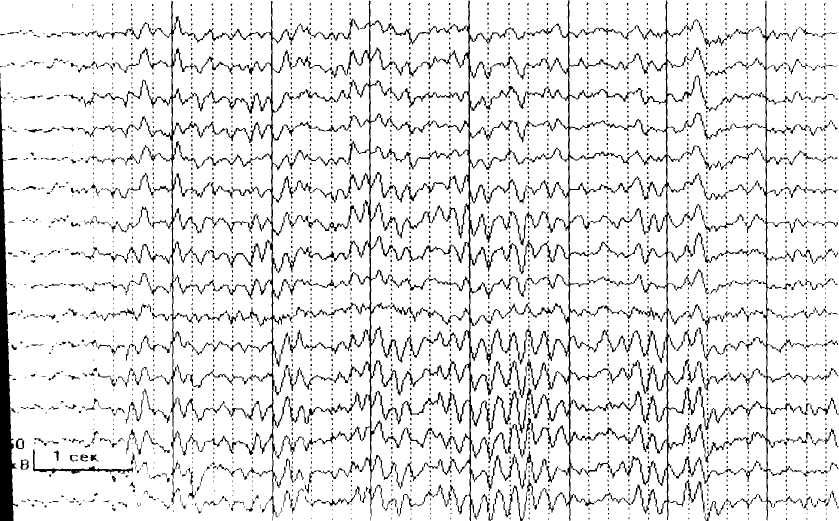
Рис.11 . 1 стадия СР. ЭЭГ бодрствования ребенка 1 г 7 мес с задержкой моторного развития. В затылочных зонах коры преобладает низкочастотный альфа-ритм частотой 6-7 Гц.
Вторая стадия течения заболевания характеризуется уплощением ЭЭГ с отчетливой редукцией альфа-активности в затылочных зонах коры (Рис.12.)

Рис.12 2 стадия течения болезни. ЭЭГ ребенка 2 г 2 мес. с регрессом моторных и речевых навыков. Уплощенная ЭЭГ с отсутствием альфа-ритма.
Сравнение данных ЭЭГ-картирования с возрастной нормой выявляет характерное для этой стадии заболевания снижение амплитуды спектральной плотности в сравнении с нормативными данными практически во всех зонах коры. Более всего выражено снижение значений спектральной плотности в полосе 8-10 Гц (Рис. 13).
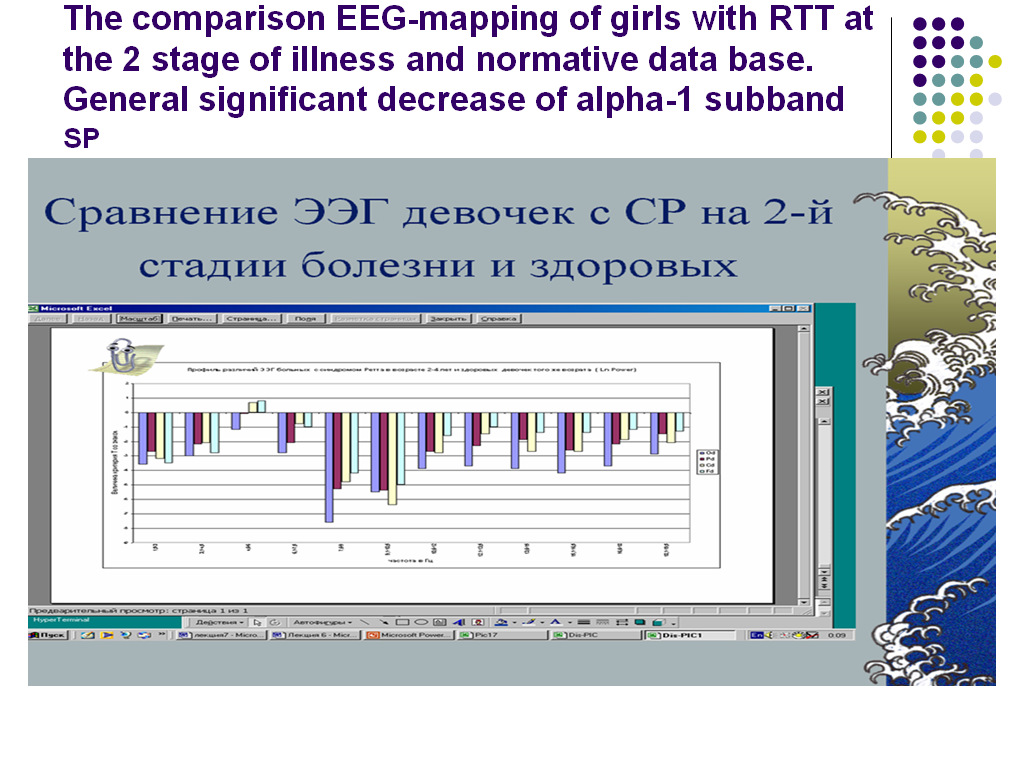
Рис. 13. Сравнение значений спектральной плотности (СП) в полосе частот от 1 до 20 Гц с использованием t-критерия Стьюдента группы больных с синдромом Ретта во второй стадии течения болезни с группой здоровых испытуемых того же возраста. Слева значения t-критерия Стьюдента. Видно выраженное снижение значений СП,особенно в альфа-полосе частот.
Для 111 стадии СР характерно снижение индекса альфа- активности , появление ритмической тета- активности и эпилептических проявлений.
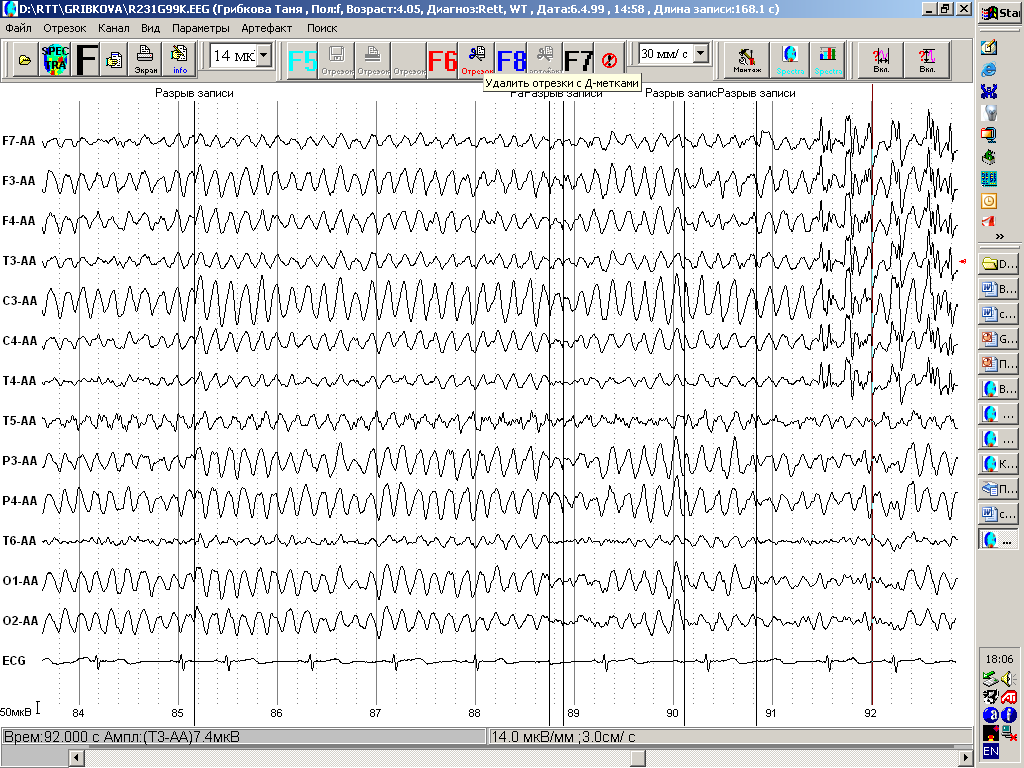
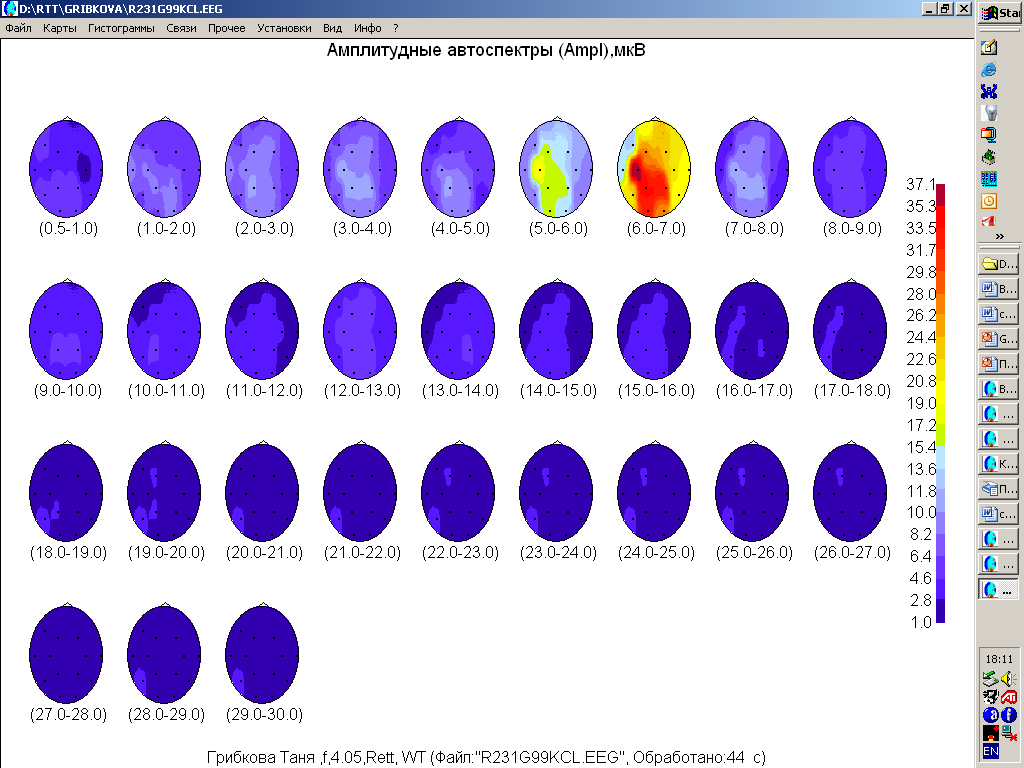
Рис.14 ЭЭГ бодрствования ребенка 4 лет 5 мес . 3 стадия синдрома Ретта. Во всех зонах коры доминирует ритмическая тета-активность частотой 6-7 Гц. Справа - топографическое картирование ЭЭГ у того же ребенка. Виден отчетливый фокус тета-активности в центрально-височных зонах левого полушария.
Для 1У стадии заболевания характерно усиление ритмической тета- дельта- активности (Рис. 15). Однако, в зрелом возрасте у больных с СР может регистрироваться уплощенная ЭЭГ с плохо выраженными зональными различиями (Niedermeyer, 1986).
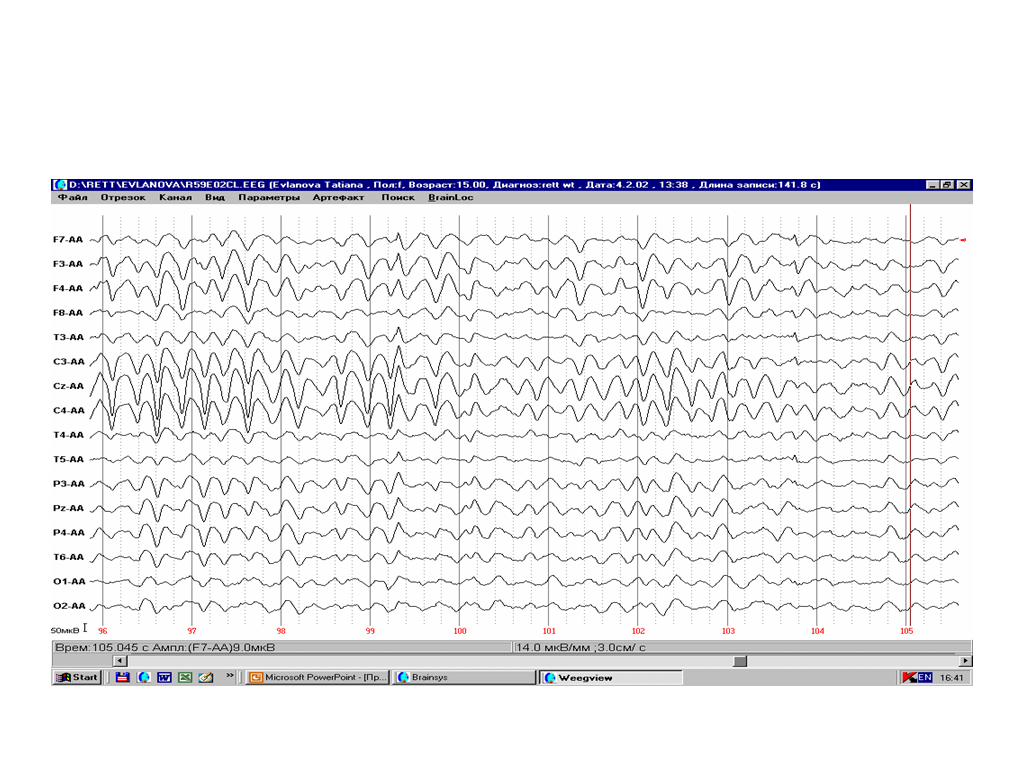
Рис.15. 4 стадия СР. ЭЭГ девочки в возрасте 15 лет. В ЭЭГ преобладает ритмическая тета-дельта-активность с фокусом в лобно-центральных отведениях.
ЭЭГ сна у больных СР. По данным ряда исследователей, занимающихся изучением сна у больных с СР уже на 11 стадии заболевания отмечено разрушение веретен сна (Piazza,1990). А. Ishizaky (1992) связывает их исчезновение с появлением эпи- активности в ЭЭГ. В 111 стадии заболевания во время сна отмечены периодически повторяющиеся вспышки высокоамплитудных дельта волн на фоне низкоамплитудной ЭЭГ. Для больных этой группы характерна эпилептическая активность во время сна в виде локальных спайков в центрально- теменных и височных отведениях Другим типом эпилептических проявлений в ЭЭГ сна является электроэнцефалографический эпилептический статус.
Эпилептическая активность. Частота этой активности в популяции больных колеблется от 30% до 80%. Наиболее распространенной формой эпи-активности у больных с этим синдромом является фокальная спайковая активность в теменно-центральных отведениях или височных отведениях чаще унилатеральная, реже – билатерально –синхронная (Рис.16.).
.

Рис.16. ЭЭГ больной М. в возрасте 4г 4 м. Регистрируются независимые очаги эпилептической активности в центрально-височных зонах правого полушария и теменно-затылочных- левого.
. В исследовании Verma et al(1986) у 25% больных были обнаружены генерализованные спайк-волновые разряды частой около 1 Гц . Такого рода нарушения были выявлены автором как в период сна, так и во время бодрствования. Такой ЭЭГ-паттерн можно рассматривать как электроэнцефалографическую картину эпилептического статуса.
Таким образом, ЭЭГ больных с синдром Ретта демонстрируют определенную возрастную динамику. Она проявляется в постепенном исчезновении ритмической альфа-активности, появлении и постепенном увеличении ритмической тета-активности, и появлении эпилептиформных разрядов. Ритмическая тета-активность, которую мы рассматриваем как медленный вариант роландического ритма, сначала регистрируется преимуществено в теменно- центральных отведениях и депрессируется на активные и пассивные движения, звук, шум, зов. Позднее реактивность этого ритма уменьшается.
Однако даже на одной стадии течения заболевания выявляется значительный клинический полиморфизм. В электроэнцефалограмме также могут наблюдаться различные паттерны, которые определяются типом мутации и уровнем смещения от равной инактивации хромосомы Х. Сравнение тяжести проявления различных клинических показателей в баллах у детей с разным типом мутации : обрывающей мутацией (нонсенс) или мутацией замены (миссенс) приведено на рис. 17 (Данные В.Ю.Воиновой). Как видно из рисунка, при миссенс мутации заболевание протекает несколько легче.

Рис.17 Сравнение клинических проявлений заболевания у детей с разным типом мутации гена MeCP2
Исследование корреляции выраженности различных клинических показателей с количественными параметрами ЭЭГ показало, что уровень внимания, эмоционального реагирования и контакта отрицательно коррелирует с уровнем тета-активности.
Сравнение данных ЭЭГ-картирования у детей с разным типом мутации (Рис.18) показывает, что у детей с обрывающими мутациями больше выражена медленная активность и меньше- активность альфа и бета-полосы частот.

Рис.18 Сравнение показателей относительной мощности спектра ЭЭГ у группы детей с нонсенс мутациями и группы детей с миссенс мутациями гена МеСР2.
Оказалось, что клинические проявления и рисунок электроэнцефалограммы еще в большей мере могут зависеть от степени смещения от равной инактивации хромосомы Х. У всех лиц женского пола, как известно, 2 хромосомы Х. Одна их них имеет отцовское происхождение, а другая- материнское. В каждой клетке организма работает только одна Х-хромосома, либо материнская, либо отцовская, вторая хромосома Х инактивирована, с нее информация не считывается. В норме количество клеток, которые содержат материнские и отцовские хромосомы Х приблизительно одинаково, около 50% . При Х- сцепленных заболеваниях это равенство нарушается. По данным В.Ю.Воиновой у 40% детей с синдромом Ретта имеет место смещенная Х- инактивация, т.е. количество клеток, которые будут содержать Х хромосому с мутантной версией гена МеСР2 может быть существенно больше или меньше 50% уровня. Чем большее число клеток будет содержать нормальную копию гена, тем легче будет протекать заболевание. На рис. 19 представлены ЭЭГ двух девочек с синдромом Ретта с одним и тем же типом мутации, но с различным уровнем инактивации хромосомы Х. ЭЭГ девочки, у которой всего 2% клеток содержат мутантную копию гена, мало отличается от нормальной, тогда как при равно1Х-инактивации
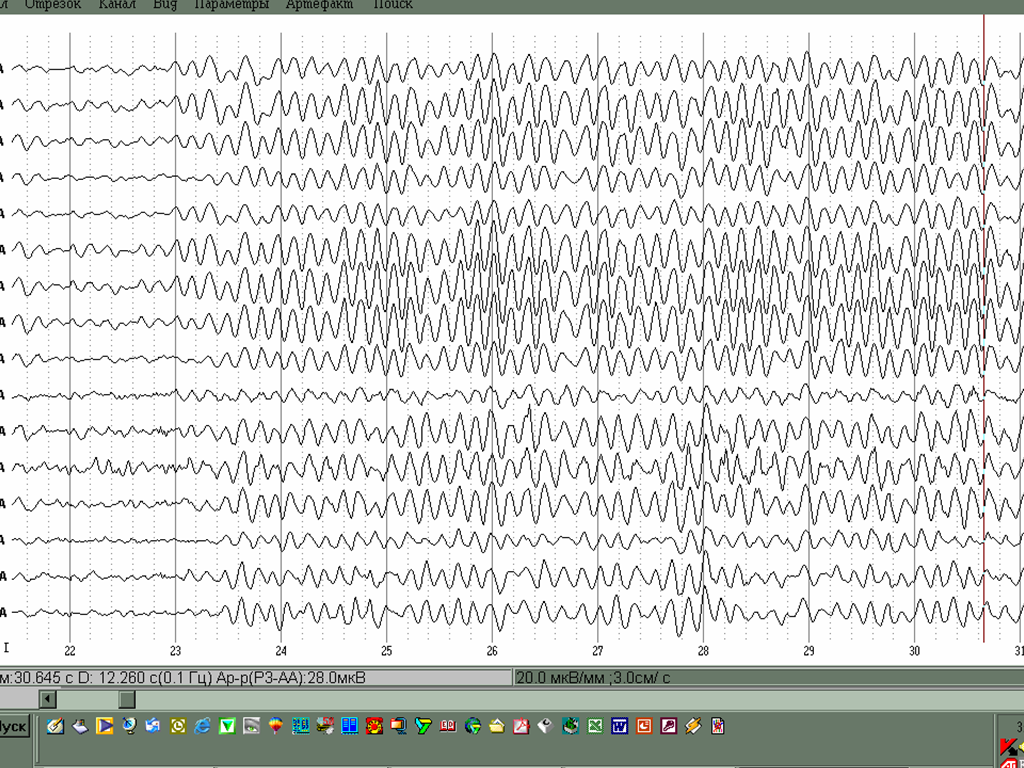
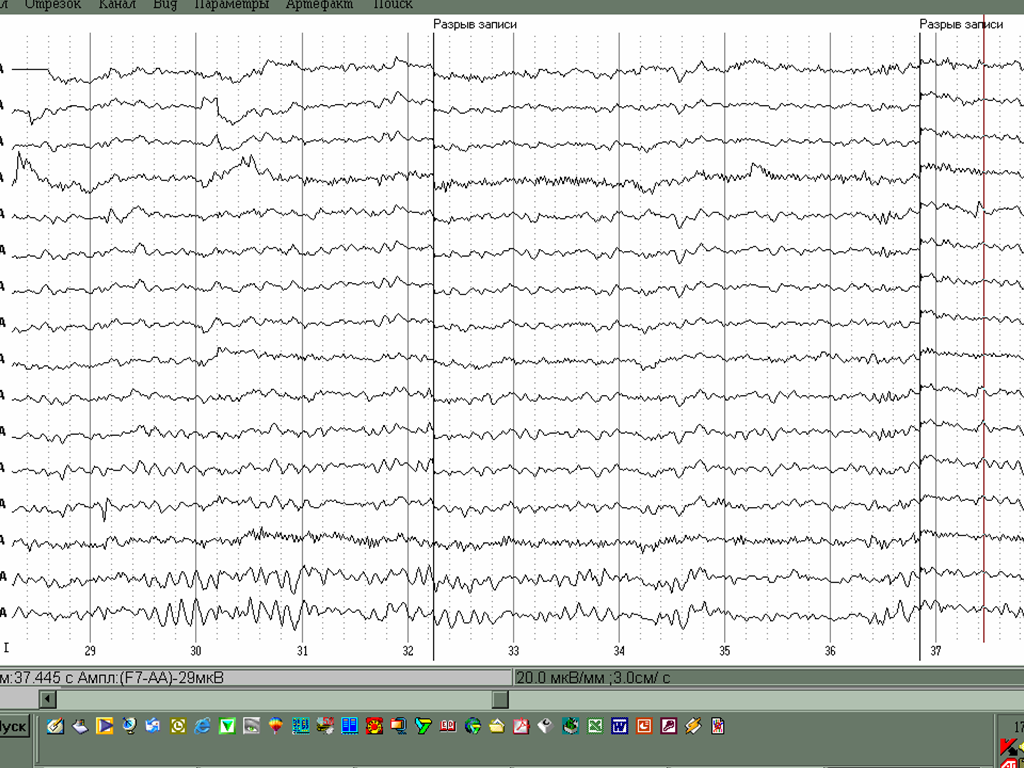
Рис.19 А Б
А - ЭЭГ больной С. в возрасте 6 лет с миссенс мутацией 306С и равной Х-инактивацией: 48/52. Регистрируются генерализованная тета-активность с фокусом в центрально-лобных зонах коры. Б- ЭЭГ больной Р. С такой же мутацией 306С, но с выраженным смещением Х-инактивации : 2/98. ЭЭГ содержит фрагменты низкочастотного альфа-ритма, тета-активность практически отсутствует.
Обобщая полученные данные можно высказать предположение, что тяжесть нарушений, которые возникают у больных из-за нарушения функционирования гена –регулятора МеСР2, не зависит от уровня, который достигли дети в своем моторном и речевом развитии до периода регресса, а определяется типом и положением мутации, а также степенью смещения от равной инактивации хромосомы Х. Разрушение альфа-активности коррелирует с распадом высших форм психической деятельности и отражает, по-видимому, вовлечение в патологический процесс коры головного мозга. Значительная депрессия роландического ритма коррелировала с двигательными стереотипиями, которые максимально выражены на начальной стадии болезни и постепенно уменьшаются, что отражается в частичном его восстановлении в ЭЭГ детей старшего возраста. Появление эпилептоидной активности и медленного роландического ритма в центральных зонах коры отражает (согласно гипотезе E.Niedermeyer, 1997) активацию подкорковых структур мозга в результате нарушения тормозного контроля со стороны лобных зон коры.
Сочетанность и совпадение во времени отрешения, выпадения речи и навыков целенаправленных движений позволяет высказать предположение, что в начале заболевания патологический процесс поражает преимущественно корковые структуры. Во второй стадии заболевания уплощение ЭЭГ может отражать высокий уровень корковой активации за счет выпадения тормозных интернейронов коры г.м.. Исследование корковой проводимости с помощью транскраниальной магнитной стимуляции, показало значительное укорочение времени проведения сигнала в коре у детей во второй стадии СР, что служит доказательством корковой гипервозбудимости и связано с нарушением тормозного контроля моторной системы преимущественно на уровне коры головного мозга (Heinen F,1997). Появление фокальных эпилептиформных приступов также позволяет предположить, прежде всего, вовлечение в патологический процесс корковых структур. Патомофологические исследования (Беличенко, 1996) показали нарушения синаптических контактов на пирамидных клетках коры головного мозга.. Т.о., можно предположить, что при РС сначала функционально выключаются лобные отделы коры, что приводит к растормаживанию моторной проекционной зоны и структур стриопалидарного уровня, а это, в свою очередь, приводит к появлению моторных стереотипий. На поздних стадиях болезни образуется новая, довольно устойчивая динамическая функциональная система с доминированием активности субкортикальных структур мозга, что проявляется в ЭЭГ моноритмичной активностью тета-диапазона (медленного роландического ритма.
В заключении хочется еще раз отметить, что значительный прогресс в понимании нейробиологии психических расстройств требует совершенствования методов диагностики психических заболеваний в которых немаловажную роль играет и метод количественной ЭЭГ. Важно помнить, что комплекс количественных данных ЭЭГ можно использовать для дифференциально-диагностических уточнений только при сопоставлении их с нормативной базой данных.
