
- •Тема 1.1. Основи хімічної термодинаміки . . . . . . . . . . . . . . . . . . . . . . 7
- •Тема 1.2. Фазова рівновага та вчення про розчини. . . . . . . . . . . . ..27
- •Тема 1.3 Електрохімія. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .47
- •Тема 1.1. Основи хімічної термодинаміки план
- •1. Зміст та основні поняття термодинаміки
- •2. Перше начало термодинаміки. Ентальпія
- •3. Закон гесса
- •Наслідки закону Гесса
- •Кількість енергії, що витрачається різними категоріями людей
- •4. Друге начало термодинаміки
- •5. Термодинамічні потенціали і фактори
- •Типи реакцій та умови їх протікання в залежності від
- •6. Розрахунок термодинамічних потенціалів в хімічних реакціях
- •Термодинамічні властивості деяких речовин
- •Тим, хто хоче знати більше Термодинаміка біохімічних процесів
- •Контрольні запитання
- •Тема 1.2. Фазова рівновага та вчення про розчини план:
- •1. Загальна характеристика розчинів
- •2. Розчини газів в рідинах. Закон генрі
- •Розчинність газів у воді при різних температурах, м3 газу/м3 води
- •Розчинність твердих речовин в рідинах
- •4. Дифузія і осмос в розчинах. Закон вант-гоффа
- •Явище осмосу. Закон вант - гоффа
- •Практичне значення осмосу
- •5. Тиск пари над розчинами. Закон рауля
- •6. Температура кристалізації і кипіння розчинів
- •Кріоскопічні і ебуліоскопічні сталі для деяких розчинників
- •7. Фазові переходи. Фазова рівновага
- •Класифікація гетерогенних систем
- •Тим, хто хоче знати більше розчинники, їх характеристика
- •Контрольні запитання.
- •Тема 1.3. Електрохімія електрична провідність розчинів. План
- •Предмет електрохімії
- •2. Електропровідність розчинів електролітів,
- •Вимірювання електропровідності
- •3. Електродний потенціал. Рівняння нернста
- •Ряд стандартних електродних потенціалів
- •С тандартні електродні та окисно-відновні потенціали у водних розчинах при 298к
- •4. Класифікація електродів
- •Класифікація електродів
- •Тим, хто хоче знати більше електрохімічні елементи
- •Контрольні запитання:
- •Тема 1.4. Хімічна кінетика і каталіз план
- •1.1. Природа речовин, що реагують
- •1.2. Агрегатний стан речовин
- •1.3. Площа поверхні зіткнення речовин, що реагують
- •1.4. Вплив тиску
- •1.5. Концентрація реагуючих речовин
- •2. Залежність швидкості реакції від температури
- •3. Складні реакції. Ланцюгові реакції
- •Ланцюгові реакції
- •4. Фотохімічні реакції
- •Каталіз і каталізатори
- •Ферментативний каталіз
- •Тим, хто хоче знати більше вплив температури на швидкість біологічних процесів
- •Література
Типи реакцій та умови їх протікання в залежності від
ΔН, ΔS, ΔG
Тип реакції
|
Знак |
Принципова можливість і умови протікання реакції |
||
ΔН |
ΔS |
ΔG |
||
1 |
- |
+ |
- |
Можлива при любій температурі |
2 |
+ |
- |
+ |
Принципово неможлива |
3 |
- |
- |
- + |
Можлива при низьких температурах |
4 |
+ |
+ |
+ - |
Можлива при високих температурах |
Таким чином, використовуючи ізобарно-ізотермічний потенціал (енергію Гіббса), можна отримати відповідь на питання принципової можливості самодовільного протікання того чи іншого процесу в певному напряму. Це дає можливість керувати складними технологічними процесами і досягати запланованих результатів (табл.1.2).
6. Розрахунок термодинамічних потенціалів в хімічних реакціях
В виробничих або лабораторних умовах частіше зустрічаються процеси, що йдуть при постійних Р і Т, тому для встановлення можливості протікання процесу необхідно визначити значення ΔG.
Для розрахунку ΔG в хімічних реакціях користуються рівнянням:
ΔG = Σ (ΔGзвор.) кінц __ - Σ (ΔGзвор.) вих.
Де ΔGзвор – зміна ізобарного потенціалу при утворенні з’єднань з простих речовин.
Значення ΔGзвор сильно залежить від температури, тому розрахунки ведуть для стандартних умов, що дозволяє одержати значення ΔG, які можна порівняти.
Стандартними умовами вважається тиск Р = 101,3 кПа і температура 25оС (298 К).
Величину ΔGзвор. при стандартних умовах прийнято позначати як: ΔGо298, для більшості речовин вона відома і приведена в довідниках.
Приклад розрахунку:
Розрахувати ΔGо298, для реакції:
СО2 (г) + 2Н2О(р.) = СН4 (г) + 2 О2 (г)
і на основі одержаних даних визначити принципову можливість реакції.
З довідника візьмемо стандартні потенціали утворення речовин, що приймають участь в реакції:
СО2 (г) ΔGо298 = - 394,64 кДж/моль,
Н2О(р.) ΔGо298 = - 237,4 кДж/моль
СН4 (г) ΔGо298 = - 50,85 кДж/моль
О2 (г) ΔGо298 = 0
Розв’язок:
ΔG = Σ (ΔGзвор.) кінц __ - Σ (ΔGзвор.) вих.
ΔGо298 = (ΔGоСН4 + 2∙ΔGо02) - (ΔGоСО2 + 2 ΔGоН2О)
ΔGо298 = (-50,85 +0) – (-394,64 +2∙(-237,4)) = - 50,85 – (-394,64 – 474,8) = - 50,85 + 394,64 + 474,8 = - 50,85 + 869,44 = 818,59 (кДж/моль).
Таблиця 1.3
Термодинамічні властивості деяких речовин
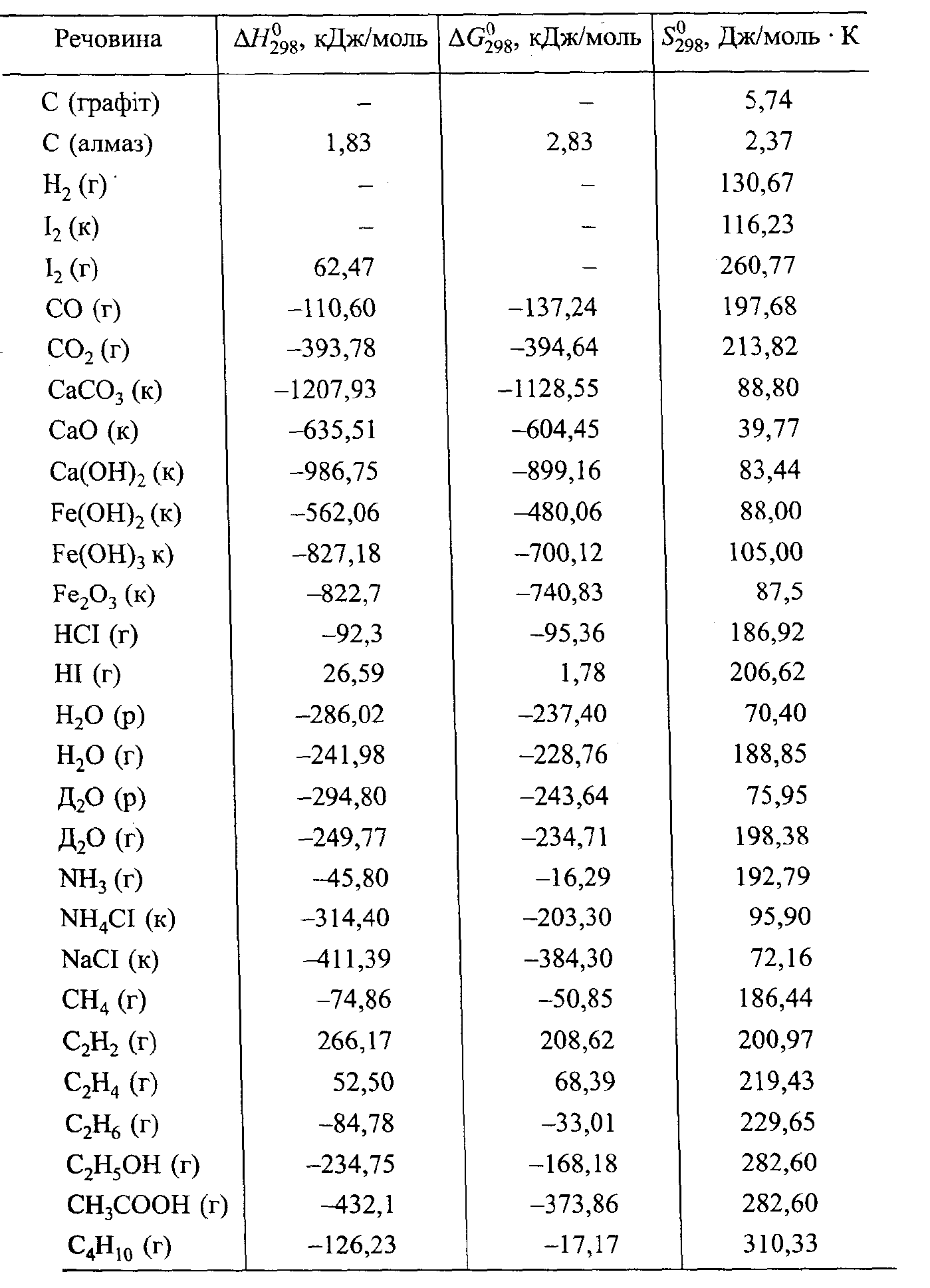
Одержана зміна ізобарного потенціалу ΔGо298 має досить велике позитивне значення. Тому можна стверджувати, що ця реакція при стандартних умовах неможлива, можлива зворотна реакція. Але зробити такий висновок для інших умов неможливо. Зміна ізобарного потенціалу речовин, які приймають участь в реакції, залежить від температури (ΔG=ΔН – ТΔS), причому ця залежність для різних речовин неоднакова. Це може привести до того, що при Т = 298 К ΔG > 0, тобто реакція принципово неможлива, а при другій температурі ΔG < 0 і тоді можна говорити про можливість даної реакції.
