
- •Тема 1.1. Основи хімічної термодинаміки . . . . . . . . . . . . . . . . . . . . . . 7
- •Тема 1.2. Фазова рівновага та вчення про розчини. . . . . . . . . . . . ..27
- •Тема 1.3 Електрохімія. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .47
- •Тема 1.1. Основи хімічної термодинаміки план
- •1. Зміст та основні поняття термодинаміки
- •2. Перше начало термодинаміки. Ентальпія
- •3. Закон гесса
- •Наслідки закону Гесса
- •Кількість енергії, що витрачається різними категоріями людей
- •4. Друге начало термодинаміки
- •5. Термодинамічні потенціали і фактори
- •Типи реакцій та умови їх протікання в залежності від
- •6. Розрахунок термодинамічних потенціалів в хімічних реакціях
- •Термодинамічні властивості деяких речовин
- •Тим, хто хоче знати більше Термодинаміка біохімічних процесів
- •Контрольні запитання
- •Тема 1.2. Фазова рівновага та вчення про розчини план:
- •1. Загальна характеристика розчинів
- •2. Розчини газів в рідинах. Закон генрі
- •Розчинність газів у воді при різних температурах, м3 газу/м3 води
- •Розчинність твердих речовин в рідинах
- •4. Дифузія і осмос в розчинах. Закон вант-гоффа
- •Явище осмосу. Закон вант - гоффа
- •Практичне значення осмосу
- •5. Тиск пари над розчинами. Закон рауля
- •6. Температура кристалізації і кипіння розчинів
- •Кріоскопічні і ебуліоскопічні сталі для деяких розчинників
- •7. Фазові переходи. Фазова рівновага
- •Класифікація гетерогенних систем
- •Тим, хто хоче знати більше розчинники, їх характеристика
- •Контрольні запитання.
- •Тема 1.3. Електрохімія електрична провідність розчинів. План
- •Предмет електрохімії
- •2. Електропровідність розчинів електролітів,
- •Вимірювання електропровідності
- •3. Електродний потенціал. Рівняння нернста
- •Ряд стандартних електродних потенціалів
- •С тандартні електродні та окисно-відновні потенціали у водних розчинах при 298к
- •4. Класифікація електродів
- •Класифікація електродів
- •Тим, хто хоче знати більше електрохімічні елементи
- •Контрольні запитання:
- •Тема 1.4. Хімічна кінетика і каталіз план
- •1.1. Природа речовин, що реагують
- •1.2. Агрегатний стан речовин
- •1.3. Площа поверхні зіткнення речовин, що реагують
- •1.4. Вплив тиску
- •1.5. Концентрація реагуючих речовин
- •2. Залежність швидкості реакції від температури
- •3. Складні реакції. Ланцюгові реакції
- •Ланцюгові реакції
- •4. Фотохімічні реакції
- •Каталіз і каталізатори
- •Ферментативний каталіз
- •Тим, хто хоче знати більше вплив температури на швидкість біологічних процесів
- •Література
3. Закон гесса
Хімічні реакції і фізико-хімічні процеси можуть відбуватися з виділенням або поглинанням енергії.
Термохімія – це розділ фізичної хімії, який вивчає теплові ефекти хімічних реакцій.
Процеси, в яких теплота виділяється, називається екзотермічними. Зрозуміло, якщо реакція екзотермічна (ΔН<0), то вміст енергії у вихідних речовинах більший, ніж у продуктах реакції.
Процеси, що протікають з поглинанням теплоти – ендотермічними. Речовини, які вступають у реакції при ендотермічних процесах, будуть мати більший запас енергії, у порівнянні з вихідними речовинами.
Кількість теплоти, що виділяється або поглинається при реакції, називається тепловим ефектом реакції. Якщо реакція протікає при постійному об’ємі, то згідно рівняння (1.6) тепловий ефект реакції:
Qv = Δ U
Якщо реакція протікає при постійному тиску Р, то згідно рівняння (1.5) тепловий ефект реакції Qp = ΔН.
Для різних розрахунків в термохімії користуються не хімічними рівняннями, а термохімічними.
Термохімічні рівняння – це запис рівняння хімічної реакції з вказанням теплового ефекту.
В термохімічних рівняннях вказують абсолютну величину і знак теплового ефекту реакції, який відноситься до одного моль вихідних речовин або продуктів реакції. Тому в термохімічних реакціях можуть бути дробові стехіометричні коефіцієнти. В цих рівняннях відмічають також агрегатний стан кожної речовини (г – газоподібне, р – рідке, т – тверде, к – кристалічне), а інколи їх алотропну форму (графіт, алмаз).
Основним законом термохімії є закон Германа Гесса (російський вчений), який встановлює, що:
тепловий ефект реакції залежить тільки від вигляду і стану початкових і кінцевих продуктів, але не залежить від проміжних станів та шляхів переходу початкових речовин до кінцевих.
Закон Гесса є окремим випадком першого закону термодинаміки, що застосовується до хімічних процесів, які протікають в ізохорних або ізобарних умовах.
В якості приклада, що підтверджує закон Гесса, розглянемо реакцію утворення діоксиду карбону. Він утворюється при безпосередньому спалюванні вугілля, але можна також провести процес в дві стадії, одержуючи на першій з них і спалюючи його на другій стадії до СО2.
С (графіт) + О2 (г) = СО2 (г); ΔН1
С
(графіт) +
![]() О2
(г) = СО(г)
; ΔН2
О2
(г) = СО(г)
; ΔН2
СО2 + О2 (г) = СО(г) ; ΔН3
Закон Гесса дозволяє зв’язувати теплові ефекти цих трьох процесів рівнянням:
ΔН1 = ΔН2 + ΔН3
Якщо два з цих теплових ефектів відомі, то легко розрахувати й третій.
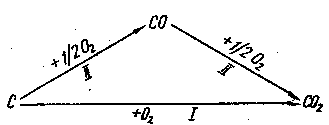
Рис. 2. Схема процесів до закону Гесса.
З цього можна зробити висновок, що згідно із законом Гесса, незалежно від того, яким шляхом ми здобули карбон (ІV) оксид (СО2) – сумарний тепловий ефект буде однаковий (рис.2).
Користуючись законом Гесса, можна розрахувати теплові ефекти таких реакцій, які або важко реалізувати, або неможливо довести до кінця, або ж зовсім для нових процесів, які ще не відбувалися. Цей закон можна застосувати як до хімічних реакцій, так і до процесів розчинення, випаровування, кристалізації, адсорбції.
