
- •Тема 1.1. Основи хімічної термодинаміки . . . . . . . . . . . . . . . . . . . . . . 7
- •Тема 1.2. Фазова рівновага та вчення про розчини. . . . . . . . . . . . ..27
- •Тема 1.3 Електрохімія. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .47
- •Тема 1.1. Основи хімічної термодинаміки план
- •1. Зміст та основні поняття термодинаміки
- •2. Перше начало термодинаміки. Ентальпія
- •3. Закон гесса
- •Наслідки закону Гесса
- •Кількість енергії, що витрачається різними категоріями людей
- •4. Друге начало термодинаміки
- •5. Термодинамічні потенціали і фактори
- •Типи реакцій та умови їх протікання в залежності від
- •6. Розрахунок термодинамічних потенціалів в хімічних реакціях
- •Термодинамічні властивості деяких речовин
- •Тим, хто хоче знати більше Термодинаміка біохімічних процесів
- •Контрольні запитання
- •Тема 1.2. Фазова рівновага та вчення про розчини план:
- •1. Загальна характеристика розчинів
- •2. Розчини газів в рідинах. Закон генрі
- •Розчинність газів у воді при різних температурах, м3 газу/м3 води
- •Розчинність твердих речовин в рідинах
- •4. Дифузія і осмос в розчинах. Закон вант-гоффа
- •Явище осмосу. Закон вант - гоффа
- •Практичне значення осмосу
- •5. Тиск пари над розчинами. Закон рауля
- •6. Температура кристалізації і кипіння розчинів
- •Кріоскопічні і ебуліоскопічні сталі для деяких розчинників
- •7. Фазові переходи. Фазова рівновага
- •Класифікація гетерогенних систем
- •Тим, хто хоче знати більше розчинники, їх характеристика
- •Контрольні запитання.
- •Тема 1.3. Електрохімія електрична провідність розчинів. План
- •Предмет електрохімії
- •2. Електропровідність розчинів електролітів,
- •Вимірювання електропровідності
- •3. Електродний потенціал. Рівняння нернста
- •Ряд стандартних електродних потенціалів
- •С тандартні електродні та окисно-відновні потенціали у водних розчинах при 298к
- •4. Класифікація електродів
- •Класифікація електродів
- •Тим, хто хоче знати більше електрохімічні елементи
- •Контрольні запитання:
- •Тема 1.4. Хімічна кінетика і каталіз план
- •1.1. Природа речовин, що реагують
- •1.2. Агрегатний стан речовин
- •1.3. Площа поверхні зіткнення речовин, що реагують
- •1.4. Вплив тиску
- •1.5. Концентрація реагуючих речовин
- •2. Залежність швидкості реакції від температури
- •3. Складні реакції. Ланцюгові реакції
- •Ланцюгові реакції
- •4. Фотохімічні реакції
- •Каталіз і каталізатори
- •Ферментативний каталіз
- •Тим, хто хоче знати більше вплив температури на швидкість біологічних процесів
- •Література
Ланцюгові реакції
Багато хімічних реакцій відбуваються через проміжні стадії, в яких беруть участь активні частинки – вільні радикали і атоми. Якщо ці активні частинки регенеруються протягом реакції, то це забезпечує її високу швидкість. Такі процеси називаються ланцюговими.
Ланцюгові реакції дуже поширені і мають велике практичне значення. Велику роль у створенні і розробці теорії ланцюгових процесів відіграли праці радянського вченого лауреата Нобелівської премії академіка М.М.Семенова та його учнів.
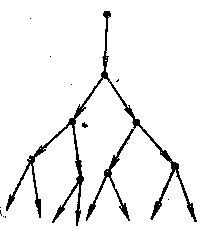
Рис. 17. Схема лавиноподібного розвитку розгалуженої ланцюгової реакції
Розрізняють ланцюгові процеси з розгалуженими (рис.17) і нерозгалуженими ланцюгами.
Кожний ланцюговий процес починається з утворення вільного радикала або атома – активних частинок, які, на відміну від молекул, мають ненасичені валентності. Такі активні частинки утворюються під дією якогось джерела енергії.
Потім відбувається взаємодія вільного радикала або атома з молекулами. Внаслідок цього в молекулі розвивається валентний зв’язок, і утворюється новий радикал або атом, який знову реагує з молекулами. Багаторазове повторення таких реакцій і утворює ланцюг.
Ланцюговими реакціями з нерозгалуженим ланцюгом називають реакції, під час яких при взаємодії однієї активної частинки щоразу утворюється лише одна нова активна частинка і кількість їх при розвитку ланцюга не збільшується.
Ланцюговими реакціями з розгалуженими ланцюгами називають реакції, під час яких внаслідок взаємодії активної частинки утворюються дві активні частинки або більше, та кількість їх швидко збільшується, і відповідно зростає швидкість хімічної реакції.
Розглянемо ланцюгову реакцію з нерозгалуженим ланцюгом — реакцію взаємодії водню з хлором. Ці реакції практично не проходять в темряві, бо для утворення НСl з Н2 і Сl2, потрібна велика енергія активації. Якщо суміш водню і хлору опромінити видимим світлом або потоком радіоактивних частинок, то утворюються атоми хлору:
С12 + hv → 2Сl•
Після цього починає розвиватись ланцюг:
Cl• + H2 → HCl + H•,
H• + Cl2 → HCl + Cl•,
Cl• + H2 → HCl + H• і т. д.
Як видно з наведених реакцій, одна активна частинка при взаємодії зникає і утворює лише одну нову активну частинку (атом водню або хлору). Отже, число активних частинок не збільшується. Якщо опромінення швидко припинити, то кількість активних частинок навіть зменшуватиметься внаслідок реакцій рекомбінації вільних радикалів у молекулу:
Н• + •Сl →НСl,
Н• + •Н → Н2,
Сl• + •Сl → Сl2.
Зазначені реакції призводять до обриву ланцюга; вільні атоми (атом-радикали) зникають, а нові активні частинки не утворюються.
Зауважимо, що ймовірність реакцій рекомбінації значно менша, ніж реакцій основного ланцюга, тому що концентрація молекул водню і хлору в системі на кілька порядків більша, ніж концентрація атомів. Ймовірність зіткнення атомів Н• з молекулами Сl2 (або Сl• з Н2 значно більша, ніж імовірність зіткнення атомів між собою.
Крім того, з'єднання двох однакових атом-радикалів, наприклад атомів водню, в молекулу можливе лише в тому разі, коли в момент зіткнення атоми віддають надлишок енергії якому-небудь тілу.
Отже, при ланцюгових реакціях з нерозгалуженим ланцюгом кількість активних частинок не тільки не збільшується при розвитку ланцюга, а навіть може частково зменшуватись внаслідок рекомбінації атомів-радикалів і обриву ланцюга. Водночас такі ланцюгові реакції можуть призвести до вибуху. Так, якщо суміш хлору з воднем при їх досить великій концентрації на короткий час освітити, то відбудеться реакція з вибухом. Вибух у цій реакції має тепловий характер.
Тепловий вибух буде тоді, коли швидкість виділення тепла при проходженні реакції значно перевищує швидкість віддачі системою тепла зовнішньому середовищу. Внаслідок цього температура реакційної суміші швидко підвищується, відповідно швидко зростає і швидкість реакції.
Отже, підвищення температури автокаталітично прискорює реакцію, внаслідок чого станеться вибух.
Взагалі для будь-якої реакційної суміші (якщо реакція екзотермічна) при досить високій концентрації реагентів швидкість виділення тепла перевищує швидкість його віддачі. Такі системи завжди вибухають. Для посудини певного розміру з певною початковою температурою Існує гранична концентрація реагентів, вище якої станеться вибух. Усе це докладно описав М. М. Семенов.
У газових системах тепло, яке виділяється під час реакції, надходить лише в зовнішнє середовище. У розчинах тепло, яке виділяється при реакції, значною мірою поглинається розчинником, який безпосередньо не бере участі в реакції. Все це знижує можливість різкого підвищення температури розчину. Крім того, підвищенню температури перешкоджає ендотермічний процес фазового переходу рідини в газ.
При ланцюгових реакціях з розгалуженим ланцюгом прогресивно і швидко зростає концентрація активних частинок, що призводить до катастрофічного зростання швидкості реакції і до вибуху. Таким чином, основним автокаталітичним фактором тут є збільшення кількості активних частинок. Характерною реакцією цього типу є реакція водню з киснем, яку докладно вивчив академік В. М. Кондратьєв. Внаслідок безпосередньої взаємодії молекул О2 і Н2 утворюються радикали •ОН, Н• і НО2:
Н2 + О2 = 2•ОН; Н2 + О2 = Н• + НО2.
Ці реакції відбуваються повільно. Але потім починаються швидкі процеси з участю радикалів:
•ОН + Н2 = Н2О + Н•,
Н• + О2= •ОН + О•,
О• + Н2 = •ОН + Н•.
Як видно з двох останніх рівнянь, одна активна частинка—атом-радикал Н• приводить до появи трьох нових активних частинок: двох частинок ОН• і одного атом-радикала Н•. Внаслідок цього в реакційній суміші з величезною швидкістю зростає число активних частинок.
З участю вільних радикалів відбуваються різноманітні хімічні процеси — реакції окислення вуглеводнів, реакції полімеризації та ін.
Вільні радикали можуть утворюватись під дією ультрафіолетових і рентгенівських променів, γ-променів, під дією нейтронів або ά-частинок, які спричинюють розрив хімічного зв'язку.
З появою вільних радикалів у клітинах живих організмів пов'язана променева хвороба. Вільні радикали, які утворюються внаслідок радіоактивного опромінення (головним чином, радикал •ОН), спричинюють ланцюговий процес у клітинах, в який втягуються ферменти, білки та інші складові частини клітини.
