
- •Тема 1.1. Основи хімічної термодинаміки . . . . . . . . . . . . . . . . . . . . . . 7
- •Тема 1.2. Фазова рівновага та вчення про розчини. . . . . . . . . . . . ..27
- •Тема 1.3 Електрохімія. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .47
- •Тема 1.1. Основи хімічної термодинаміки план
- •1. Зміст та основні поняття термодинаміки
- •2. Перше начало термодинаміки. Ентальпія
- •3. Закон гесса
- •Наслідки закону Гесса
- •Кількість енергії, що витрачається різними категоріями людей
- •4. Друге начало термодинаміки
- •5. Термодинамічні потенціали і фактори
- •Типи реакцій та умови їх протікання в залежності від
- •6. Розрахунок термодинамічних потенціалів в хімічних реакціях
- •Термодинамічні властивості деяких речовин
- •Тим, хто хоче знати більше Термодинаміка біохімічних процесів
- •Контрольні запитання
- •Тема 1.2. Фазова рівновага та вчення про розчини план:
- •1. Загальна характеристика розчинів
- •2. Розчини газів в рідинах. Закон генрі
- •Розчинність газів у воді при різних температурах, м3 газу/м3 води
- •Розчинність твердих речовин в рідинах
- •4. Дифузія і осмос в розчинах. Закон вант-гоффа
- •Явище осмосу. Закон вант - гоффа
- •Практичне значення осмосу
- •5. Тиск пари над розчинами. Закон рауля
- •6. Температура кристалізації і кипіння розчинів
- •Кріоскопічні і ебуліоскопічні сталі для деяких розчинників
- •7. Фазові переходи. Фазова рівновага
- •Класифікація гетерогенних систем
- •Тим, хто хоче знати більше розчинники, їх характеристика
- •Контрольні запитання.
- •Тема 1.3. Електрохімія електрична провідність розчинів. План
- •Предмет електрохімії
- •2. Електропровідність розчинів електролітів,
- •Вимірювання електропровідності
- •3. Електродний потенціал. Рівняння нернста
- •Ряд стандартних електродних потенціалів
- •С тандартні електродні та окисно-відновні потенціали у водних розчинах при 298к
- •4. Класифікація електродів
- •Класифікація електродів
- •Тим, хто хоче знати більше електрохімічні елементи
- •Контрольні запитання:
- •Тема 1.4. Хімічна кінетика і каталіз план
- •1.1. Природа речовин, що реагують
- •1.2. Агрегатний стан речовин
- •1.3. Площа поверхні зіткнення речовин, що реагують
- •1.4. Вплив тиску
- •1.5. Концентрація реагуючих речовин
- •2. Залежність швидкості реакції від температури
- •3. Складні реакції. Ланцюгові реакції
- •Ланцюгові реакції
- •4. Фотохімічні реакції
- •Каталіз і каталізатори
- •Ферментативний каталіз
- •Тим, хто хоче знати більше вплив температури на швидкість біологічних процесів
- •Література
Вимірювання електропровідності
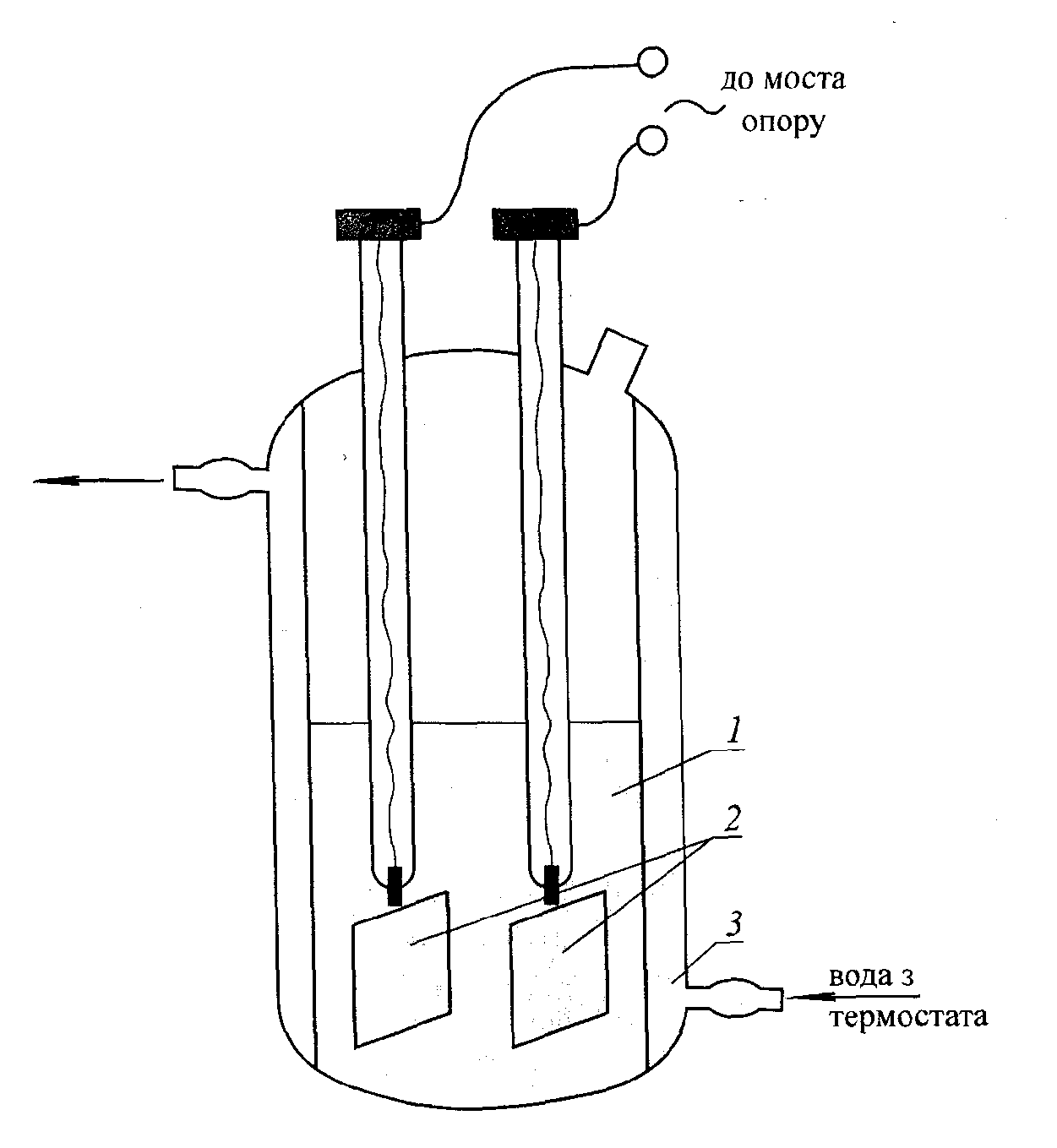 Електропровідність
розчинів електролітів
визначають, вимірюючи їх опір протіканню
електричного струму між двома зануреними
в розчин електродами. Звичайно для цього
застосовують змінний струм частотою
500-800Гц, що дозволяє значно зменшити
вплив процесів електролізу та поляризації
на результати вимірювань. Для дослідів
застосовують спеціальні мости опору,
одним з плечей яких служить посудина з
впаяними платиновими електродами різних
конструкцій. Важливо, щоб форма та
розміщення електродів, об’єм електроліту
і температура під час вимірювань
залишались незмінними. На рис.15 показано
конструкцію одного з датчиків, що з
успіхом застосовується для вимірювань
електропровідності розчинів у лабораторній
практиці. Вимірюючи електропровідність
розчинів, можна визначити розчинність
малорозчинних солей у воді чи грунті,
вологість різних об’єктів, вміст кислот
у розчинах та ін.
Електропровідність
розчинів електролітів
визначають, вимірюючи їх опір протіканню
електричного струму між двома зануреними
в розчин електродами. Звичайно для цього
застосовують змінний струм частотою
500-800Гц, що дозволяє значно зменшити
вплив процесів електролізу та поляризації
на результати вимірювань. Для дослідів
застосовують спеціальні мости опору,
одним з плечей яких служить посудина з
впаяними платиновими електродами різних
конструкцій. Важливо, щоб форма та
розміщення електродів, об’єм електроліту
і температура під час вимірювань
залишались незмінними. На рис.15 показано
конструкцію одного з датчиків, що з
успіхом застосовується для вимірювань
електропровідності розчинів у лабораторній
практиці. Вимірюючи електропровідність
розчинів, можна визначити розчинність
малорозчинних солей у воді чи грунті,
вологість різних об’єктів, вміст кислот
у розчинах та ін.
Рис.15. Схема посудини для вимірювання електропровідності розчинів електролітів:
1 – розчин електроліту; 2 - електроди; 3 - кожух для подачі теплоносія.
3. Електродний потенціал. Рівняння нернста
Якщо занурити металеву пластинку (електрод) у розчин електроліту, то між пластинкою і розчином виникає різниця потенціалів, яка має назву електродного потенціалу.
На рис. 16 зображено процеси, що протікають на межі розділу фаз: в результаті гідратації іонів поверхні металу (Меn+) їх зв’язок з кристалічною граткою послаблюється, і вони переходять в розчин. Поверхня металу набуває негативного заряду. Процес швидко досягає стану рівноваги.
При цьому на поверхні металу виникає подвійний електричний шар, падіння напруги в якому називають електродним потенціалом. Кількість іонів, які переходять у розчин з металу, безумовно залежить від їх концентрації в ньому.
Електростатичному притяжінню протидіють сили взаємного відштовхування катіонів та їх тепловий рух. Тому подвійний електричний шар має дифузійну будову, концентрація катіону в ньому убуває по мірі віддалення від поверхні металу.
Виникнення подвійного електричного шару пов”язане з протіканням на межі метал – розчин рівноважних електрохімічних реакцій.
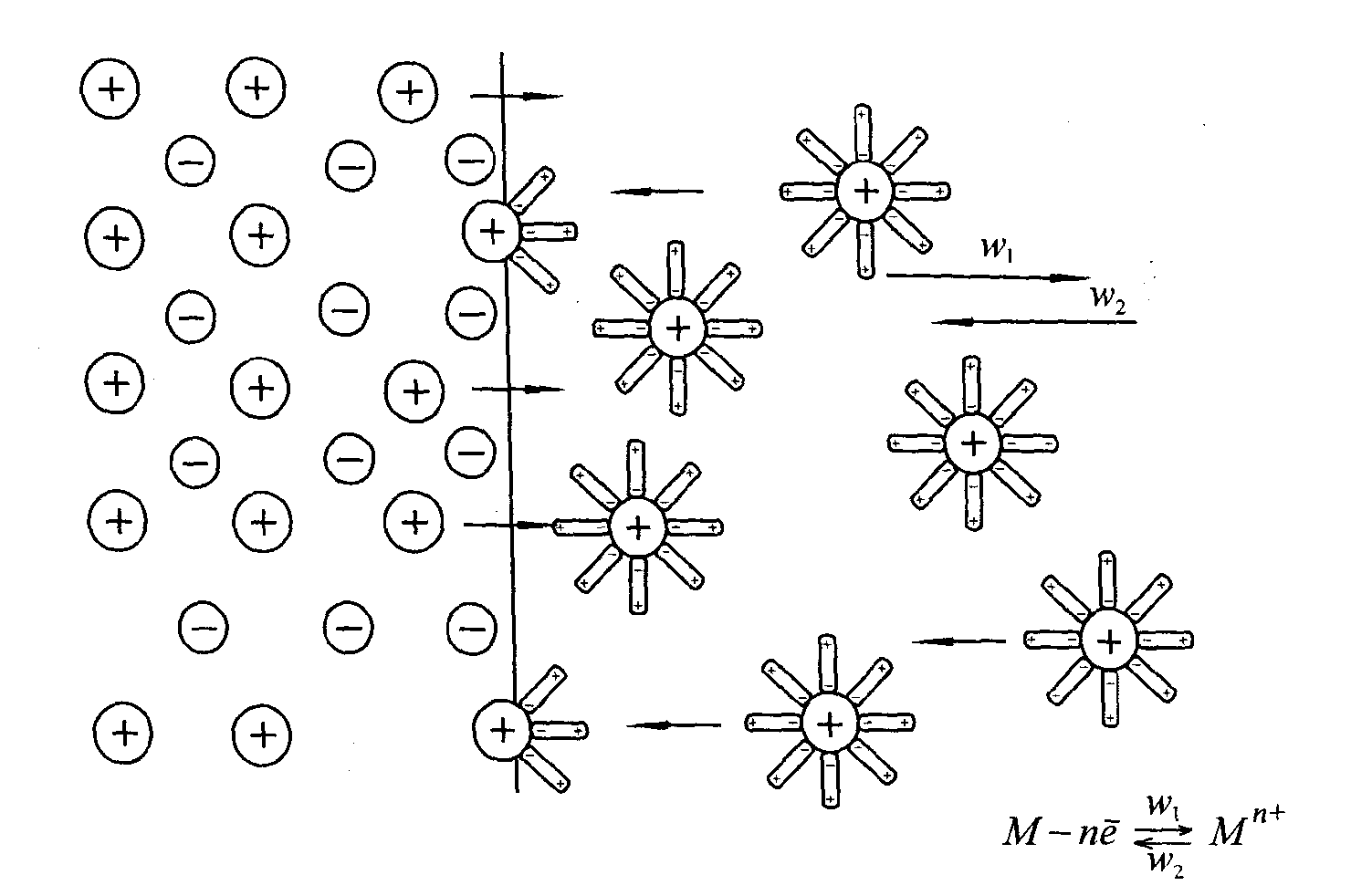
Рис. 16. Перехід іонів металу в розчин під впливом гідратації.
Електродний рівноважний потенціал залежить від активності іонів металу в розчині і температури.
Цю залежність виражають рівнянням Нернста:
Е = Ео
+
![]() lna,
lna,
де Е - електродний потенціал, В;
Ео – стандартний електродний потенціал – потенціал електроду при активності іонів, що дорівнює 1;
R -
універсальна газова стала; R
= 8,314
![]() ;
;
Т – температура, К;
n-зарядове число іона;
F-
cтала Фарадея;
F = 9,648
104
![]()
а - активність іонів в розчині.
Для досить
розведених розчинів активність іонів
в рівнянні Нернста можна замінити
моляльністю m,
![]() або концентрацією:
або концентрацією:
Е = Ео + lnm або Е = Ео + lnс
Для температури 298 К (25оС) рівняння Нернста при переході від натурального логарифма до десятичного приймає ще постійний вигляд:
Е = Ео
+
![]() lgm
lgm
Абсолютне значення електродного потенціалу безпосередньо визначити неможливо. Тому для проведення дослідів застосовують умовну величину, що характеризує потенціал електроду відносно потенціалу іншого електроду, взятого за стандарт (електрод порівняння).
Звичайно в якості електроду порівнювача використовують стандартний водневого електрод, потенціал якого дорівнює нулю.
Стандартний електродний потенціал – це електродний потенціал, що виникає при зануренні металу у розчин, в якому активність іонів цього металу становить 1 моль/л.
Відносно потенціалу цього електроду, всі стандартні потенціали металевих електродів будуть або позитивнішими, або від”ємнішими від нього.
Якщо розташувати метали в порядку зростання значень їх стандартних потенціалів, то одержимо ряд стандартних електродних потенціалів, або електрохімічний ряд напруг:
Таблиця 1.8
