
- •Тема 1.1. Основи хімічної термодинаміки . . . . . . . . . . . . . . . . . . . . . . 7
- •Тема 1.2. Фазова рівновага та вчення про розчини. . . . . . . . . . . . ..27
- •Тема 1.3 Електрохімія. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .47
- •Тема 1.1. Основи хімічної термодинаміки план
- •1. Зміст та основні поняття термодинаміки
- •2. Перше начало термодинаміки. Ентальпія
- •3. Закон гесса
- •Наслідки закону Гесса
- •Кількість енергії, що витрачається різними категоріями людей
- •4. Друге начало термодинаміки
- •5. Термодинамічні потенціали і фактори
- •Типи реакцій та умови їх протікання в залежності від
- •6. Розрахунок термодинамічних потенціалів в хімічних реакціях
- •Термодинамічні властивості деяких речовин
- •Тим, хто хоче знати більше Термодинаміка біохімічних процесів
- •Контрольні запитання
- •Тема 1.2. Фазова рівновага та вчення про розчини план:
- •1. Загальна характеристика розчинів
- •2. Розчини газів в рідинах. Закон генрі
- •Розчинність газів у воді при різних температурах, м3 газу/м3 води
- •Розчинність твердих речовин в рідинах
- •4. Дифузія і осмос в розчинах. Закон вант-гоффа
- •Явище осмосу. Закон вант - гоффа
- •Практичне значення осмосу
- •5. Тиск пари над розчинами. Закон рауля
- •6. Температура кристалізації і кипіння розчинів
- •Кріоскопічні і ебуліоскопічні сталі для деяких розчинників
- •7. Фазові переходи. Фазова рівновага
- •Класифікація гетерогенних систем
- •Тим, хто хоче знати більше розчинники, їх характеристика
- •Контрольні запитання.
- •Тема 1.3. Електрохімія електрична провідність розчинів. План
- •Предмет електрохімії
- •2. Електропровідність розчинів електролітів,
- •Вимірювання електропровідності
- •3. Електродний потенціал. Рівняння нернста
- •Ряд стандартних електродних потенціалів
- •С тандартні електродні та окисно-відновні потенціали у водних розчинах при 298к
- •4. Класифікація електродів
- •Класифікація електродів
- •Тим, хто хоче знати більше електрохімічні елементи
- •Контрольні запитання:
- •Тема 1.4. Хімічна кінетика і каталіз план
- •1.1. Природа речовин, що реагують
- •1.2. Агрегатний стан речовин
- •1.3. Площа поверхні зіткнення речовин, що реагують
- •1.4. Вплив тиску
- •1.5. Концентрація реагуючих речовин
- •2. Залежність швидкості реакції від температури
- •3. Складні реакції. Ланцюгові реакції
- •Ланцюгові реакції
- •4. Фотохімічні реакції
- •Каталіз і каталізатори
- •Ферментативний каталіз
- •Тим, хто хоче знати більше вплив температури на швидкість біологічних процесів
- •Література
2. Електропровідність розчинів електролітів,
ЇЇ ВИМІРИ
Електропровідність розчинів електролітів характеризує його здатність проводити електричний струм.
Вона є величиною, оберненою електричному опору. В свою чергу опір R залежить від довжини провідника L, площі поперечного перерізу S і питомого опору ρ:
R
= р
![]() ; р =
; р =
![]()
Розрізняють питому і еквівалентну електропровідність розчинів електролітів.
Питома електропровідність – електропровідність розчину електроліту, що міститься між двома електродами площею по 1см2 кожний, розташованими на відстані 1см один від одного.
Питома електропровідність χ– це величина, обернена питомому опору ρ:
χ
=
![]() =
=
![]()
Питома електропровідність χ вимірюється:
[
χ
] =
![]() =
=
![]() = См/см
= См/см
![]() =
См
(Сименс)
=
См
(Сименс)
І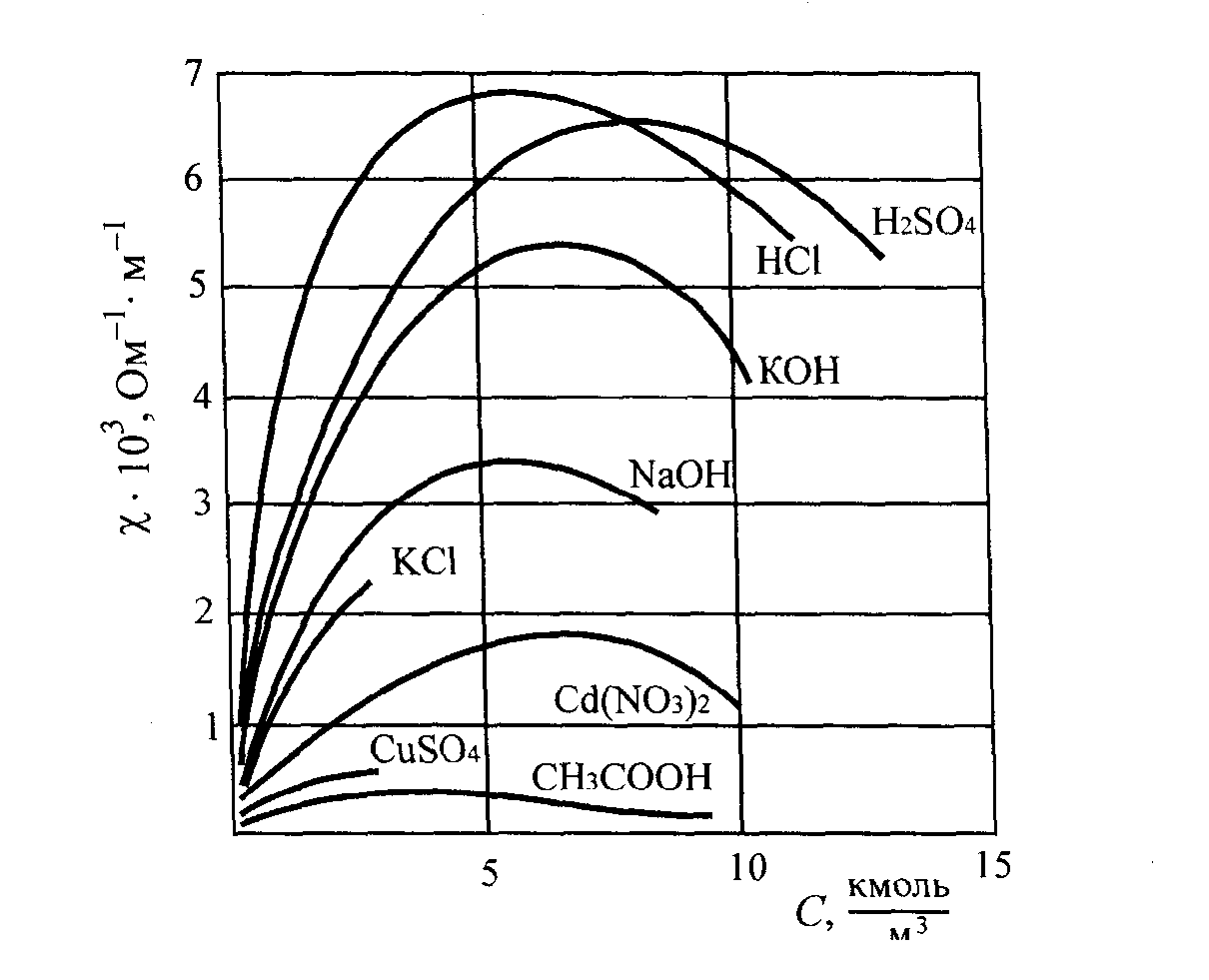 з
збільшенням концентрації електроліту,
а, отже, і концентрації іонів, питома
електропровідність зростає
до деякої межі. При досить великій
концентрації зменшується
ступінь
дисоціації (в розчинах слабких
електролітів), або зростає вплив
взаємного притяжіння іонів ( в розчинах
сильних електролітів), що приводить
до зменшення
електропровідності. Особливо виразно
такий характер цієї залежності
проявляється для розчинів сильних
електролітів.
з
збільшенням концентрації електроліту,
а, отже, і концентрації іонів, питома
електропровідність зростає
до деякої межі. При досить великій
концентрації зменшується
ступінь
дисоціації (в розчинах слабких
електролітів), або зростає вплив
взаємного притяжіння іонів ( в розчинах
сильних електролітів), що приводить
до зменшення
електропровідності. Особливо виразно
такий характер цієї залежності
проявляється для розчинів сильних
електролітів.
Рис. 11. Залежність питомої електропровідності розчинників від їх концентрації.
Залежність питомої електропровідності від температури досить складна, бо визначається багатьма параметрами: в'язкістю середовища, ступенем дисоціації електроліту, гідратацією його іонів, швидкістю їх руху та ін. найчастіше при збільшенні температури на один градус електрична провідність зростає приблизно на 2%. Це зумовлює необхідність термостувати розчин при точних вимірюваннях.
Таким чином, питома електропровідність – це функція багатьох чинників. Визначивши цю величину експериментально, ми, проте, не маємо можливості зробити певні висновки про фізико-хімічні властивості даного розчину електроліту. Тому для зручності врахування впливу концентрації на провідність електролітів Е.Х.Ленц увів поняття про еквівалентну (молярну) електропровідність.
Для характеристики електричної провідності розчинів електролітів частіше використовують еквівалентну електропровідність.
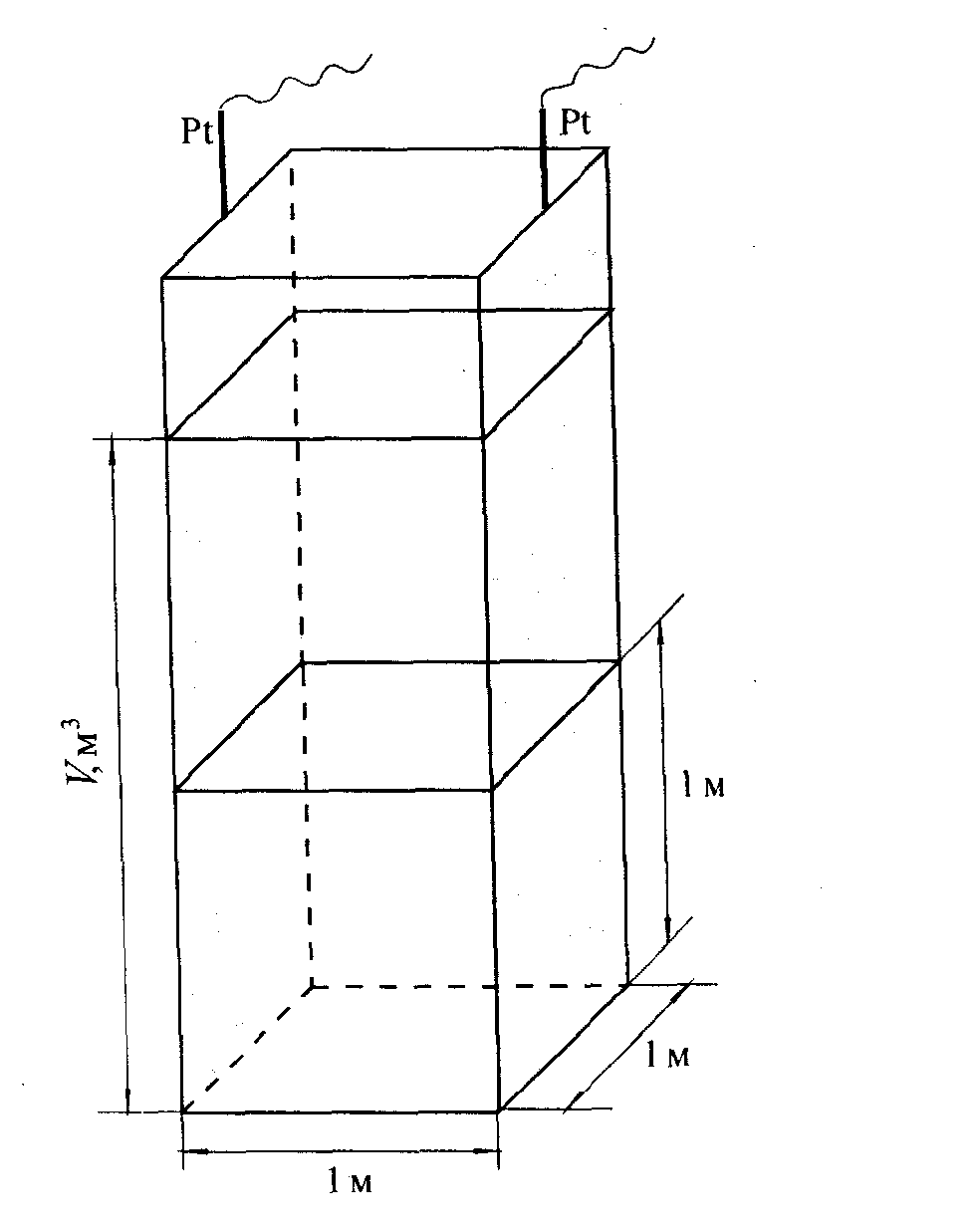
Рис. 12. Співвідношення між питомою та молярною електропровідністю.
Еквівалентна електропровідність λ – це електропровідність об’єму розчину, в якому міститься 1 моль розчиненої речовини і який помістили між електродами, відстань між якими дорівнює 1 см.
На рис.12 видно, що “робоча” площа електродів визначається об’ємом розчину. Одиниця еквівалентної електропровідності.
[
λ ] =
![]()
У
системі СІ термін «еквівалентна
електропровідність» замінено на
молярну. Між
еквівалентною і питомою електропровідністю
існує наступна залежність: λ
=
![]()
с – еквівалентна
концентрація розчину електроліту,
що виражається в
![]()
Еквівалентна провідність при розведенні розчину (зменшенні концентрації) збільшується, досягаючи при досить великому розчиненні max (максимально) і постійного значення (рис. 13). Це значення є визначеним для кожного електроліту і називається еквівалентною електропровідністю.
Розбавлення, при якому молярна провідність сягає граничного значення називають молярною електропровідністю при нескінченному розбавленні і позначають λ∞.
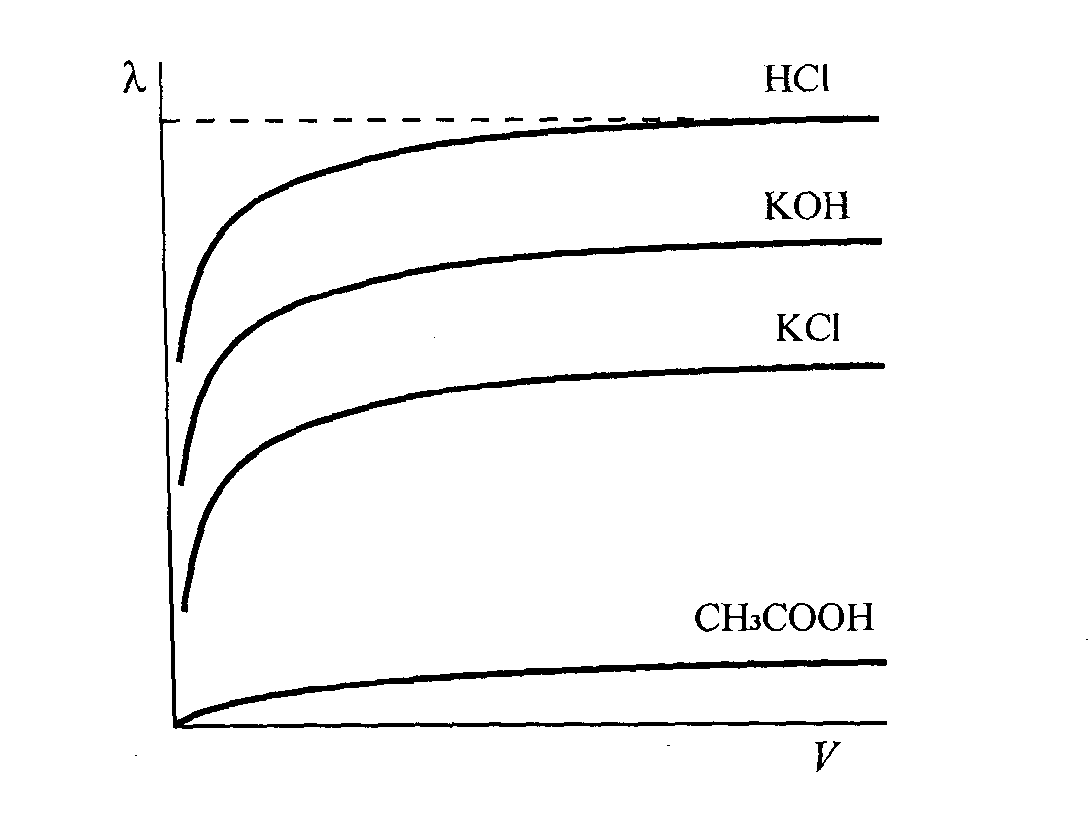
Рис.13. Залежність молярної електропровідності деяких електролітів від розбавлення розчинів.
З рис.13 бачимо, що навіть у дуже концентрованих розчинах сильних електролітів (кислоти, луги, солі) молярна електропровідність досить висока. У сильних електролітах всі молекули дисоційовані. Проте при зменшенні концентрації розчинів спостерігається помітне зростання електропровідності в основному за рахунок послаблення міжіонної взаємодії. У концентрованих розчинах слабких електролітів ступінь дисоціації, а отже, й молярна електропровідність дуже незначні. Зі зменшенням концентрації розчину ступінь дисоціації електроліту збільшується, що зумовлює зростання молярної електропровідності, яка прямує до граничного значення λ∞ для нескінченно розбавленого розчину.
Таблиця 1.7
Молярна електропровідність деяких електролітів у водних
розчинах при 298 К.

В безмежно розведеному розчині досягається повна дисоціація молекул (α = 1) і взаємодія між іонами відсутня. Кожний з іонів рухається незалежно від інших і еквівалентна електропровідність в такому випадку може бути представлена як сума електропровідностей іонів. Та частина еквівалентної електропровідності, яка приходиться на іони одного виду, називається рухливістю іону.
Еквівалентна електропровідність при великому розчиненні розчину дорівнює сумі рухливостей іонів:
λ∞ = la + lk
де la і lk - рухливість аніона і катіона.
Це рівняння називається законом незалежного руху іонів або законом Кольрауша (німецький фізик).
Рухливість іонів
виражається в тих же одиницях, що й
еквівалентна електропровідність: [ l
] =
=
![]()
Знаючи рухливість іонів, за законом Кольрауша можна розрахувати еквівалентну електропровідність при безмежному розчиненні.
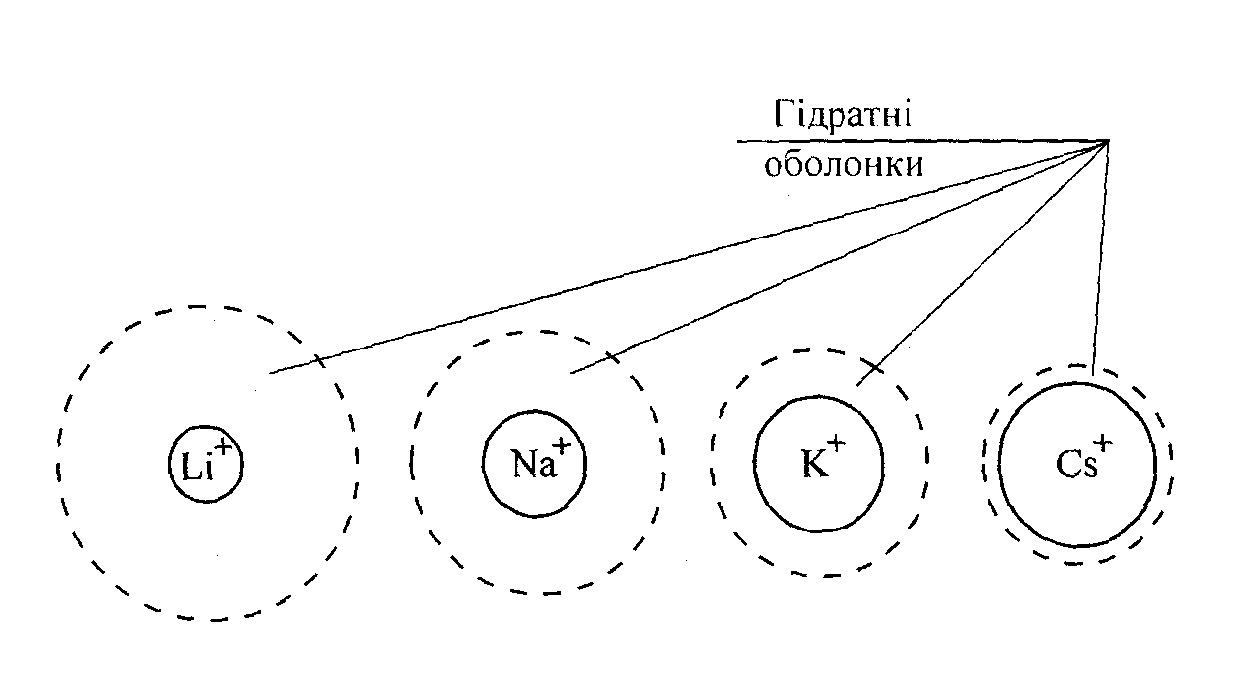 Рухливість
іонів пропорційна на швидкості їх
руху в електричному полі і тому
залежить від розмірів і степені
гідратації іонів.
Рухливість
іонів пропорційна на швидкості їх
руху в електричному полі і тому
залежить від розмірів і степені
гідратації іонів.
Рис.14. Відносні розміри іонів лужних металів (суцільні кола) та розміри цих іонів у гідратних оболонках (пунктирні кола).
Чим більший радіус іону і чим вищий ступінь його гідратації, тим менша рухливість. Досить високу рухливість мають іон гідрогену Н+ і гідроксид іон ОН-. Це пояснюється тим, що механізм переміщення цих іонів у воді відрізняється від механізму руху інших іонів.
В водних розчинах іон гідрогену знаходиться у вигляді гідроксонія Н3О+. В електричному полі протон іону гідроксонію переходить до найближчої молекули води. Знов утворений іон гідроксонію передає свій протон наступній молекулі води. Аналогічно переміщується протон в розчині від молекули води до гідроксид-іону. В обох випадках переніс електрики здійснюється не рухом іонів, а в результаті перестрибування протону від одної частинки до іншої.
 _ Н2О Н2О Н2О
Н3О+ Н2О Н2О
+
_ Н2О Н2О Н2О
Н3О+ Н2О Н2О
+
_ Н2О Н2О Н2О ОН- Н2О Н2О +
Оскільки протон в молекулі води Зв”язаний міцніше, ніж в (Н3О+) гідроксонії, то рухливість гідроксид-іону менша, ніж рухливість іонів гідрогену.
