
- •Тема 1.1. Основи хімічної термодинаміки . . . . . . . . . . . . . . . . . . . . . . 7
- •Тема 1.2. Фазова рівновага та вчення про розчини. . . . . . . . . . . . ..27
- •Тема 1.3 Електрохімія. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .47
- •Тема 1.1. Основи хімічної термодинаміки план
- •1. Зміст та основні поняття термодинаміки
- •2. Перше начало термодинаміки. Ентальпія
- •3. Закон гесса
- •Наслідки закону Гесса
- •Кількість енергії, що витрачається різними категоріями людей
- •4. Друге начало термодинаміки
- •5. Термодинамічні потенціали і фактори
- •Типи реакцій та умови їх протікання в залежності від
- •6. Розрахунок термодинамічних потенціалів в хімічних реакціях
- •Термодинамічні властивості деяких речовин
- •Тим, хто хоче знати більше Термодинаміка біохімічних процесів
- •Контрольні запитання
- •Тема 1.2. Фазова рівновага та вчення про розчини план:
- •1. Загальна характеристика розчинів
- •2. Розчини газів в рідинах. Закон генрі
- •Розчинність газів у воді при різних температурах, м3 газу/м3 води
- •Розчинність твердих речовин в рідинах
- •4. Дифузія і осмос в розчинах. Закон вант-гоффа
- •Явище осмосу. Закон вант - гоффа
- •Практичне значення осмосу
- •5. Тиск пари над розчинами. Закон рауля
- •6. Температура кристалізації і кипіння розчинів
- •Кріоскопічні і ебуліоскопічні сталі для деяких розчинників
- •7. Фазові переходи. Фазова рівновага
- •Класифікація гетерогенних систем
- •Тим, хто хоче знати більше розчинники, їх характеристика
- •Контрольні запитання.
- •Тема 1.3. Електрохімія електрична провідність розчинів. План
- •Предмет електрохімії
- •2. Електропровідність розчинів електролітів,
- •Вимірювання електропровідності
- •3. Електродний потенціал. Рівняння нернста
- •Ряд стандартних електродних потенціалів
- •С тандартні електродні та окисно-відновні потенціали у водних розчинах при 298к
- •4. Класифікація електродів
- •Класифікація електродів
- •Тим, хто хоче знати більше електрохімічні елементи
- •Контрольні запитання:
- •Тема 1.4. Хімічна кінетика і каталіз план
- •1.1. Природа речовин, що реагують
- •1.2. Агрегатний стан речовин
- •1.3. Площа поверхні зіткнення речовин, що реагують
- •1.4. Вплив тиску
- •1.5. Концентрація реагуючих речовин
- •2. Залежність швидкості реакції від температури
- •3. Складні реакції. Ланцюгові реакції
- •Ланцюгові реакції
- •4. Фотохімічні реакції
- •Каталіз і каталізатори
- •Ферментативний каталіз
- •Тим, хто хоче знати більше вплив температури на швидкість біологічних процесів
- •Література
5. Тиск пари над розчинами. Закон рауля
При випаровуванні рідини над її поверхнею утворюється пара. Процес випаровування зворотний, одночасно з ним йде і конденсація пари. При рівності швидкостей випаровування і конденсації встановлюється динамічна рівновага і насичена пара при даній температурі має сталий тиск.
З підвищенням температури тиск насиченої пари збільшується.
Тиск насиченої пари розчинника над розчином завжди менший, ніж над чистим розчинником.
Чим більша концентрація розчину, тобто чим менше молекул розчинника міститься в одиниці об’єму, тим менший тиск насиченої пари.
Отже, тиск насиченої пари розчинника над розчином пропорційний молярній частці розчинника А:
Ра = к ∙Nа ,
де Ра - тиск насиченої пари розчинника над розчином;
Nа – молярна частка розчинника.
Якщо прийняти, що Nа = 1, тобто розчиненої речовини немає, то к буде дорівнювати тиску насиченої пари над чистим розчинником Роа , або к = Роа
Тоді Ра = Роа∙ Nа (2.1)
Згідно цього рівняння:
Тиск насиченої пари розчинника над розчином дорівнює добутку його тиску над чистим розчинником на молярну частку розчинника.
Цей закон називається законом Рауля. У 1887 році французький фізик Рауль вивів цей закон, вивчаючи розчини різних нелетких рідин і твердих тіл.
Рівняння (2.1) можна представити в іншому вигляді. Молярна частка розчиненої речовини В позначимо Nв , тоді Nа + Nв = 1 і Nа = 1 – Nв.
Представивши цей вираз в рівняння (1), одержимо: Ра = Рао (1 - Nв), або
Рао - Ра = Рао Nв.
Розділивши останнє рівняння на Рао, одержимо:
Відносне зниження тиску насиченої пари розчинника над розчином дорівнює молярній частці розчиненої речовини.
Це другий варіант формулювання закону Рауля.
Р

 = Nв (2.2)
= Nв (2.2)
 Залежність
парціального тиску пари компонента
від складу є прямою лінією, яка
проходить через початок координат
(Рис. 8). Розчини, що підкоряються закону
Рауля називають ідеальними.
Залежність
парціального тиску пари компонента
від складу є прямою лінією, яка
проходить через початок координат
(Рис. 8). Розчини, що підкоряються закону
Рауля називають ідеальними.
N
Рис. 9. Залежність парціального
тиску пари компонента від
складу.
Чим більше розбавлений розчин, тим краще він підпорядковується закону Рауля і тим він ближчий до ідеального. З ростом концентрації розчину збільшується відхилення його від ідеального стану.
Відносне зниження тиску пари розчинника над розчином Ф.Рауля (1882) встановив на підставі численних експериментальних даних. Воно справджується для розчинів, коли розчинник леткий, а розчинена речовина нелетка.
6. Температура кристалізації і кипіння розчинів
На відміну від чистої рідини розчин при охолодженні не замерзає повністю при постійній температурі. При певній температурі з розчину починають виділятися кристали розчинника і, по мірі охолодження, кількість їх зростає до тих пір, поки весь розчин закристалізується.
Температурою кристалізації (замерзання) розчину вважають температуру, при якій починається утворення кристалів.
Замерзає рідина при тій температурі, при якій тиск пари речовини в твердому стані стає рівним тиску пари цієї ж речовини в рідкому стані. Наприклад, тиск пари льоду і тиск пари води однаковий і дорівнює 46мм рт.ст. при 00С, тому 00С вважається температурою замерзання води. Якщо ж взяти розчин якої-небудь речовини у воді, то в зв’язку з пониженням тиску пари при 00С він буде володіти меншим тиском пари, ніж в чистій воді. Так, наприклад, розчин, що містить 10г солі NaCl в 100г води, замерзає при температурі -13,60С, морська вода замерзає при температурі -2,50С і т.д.
П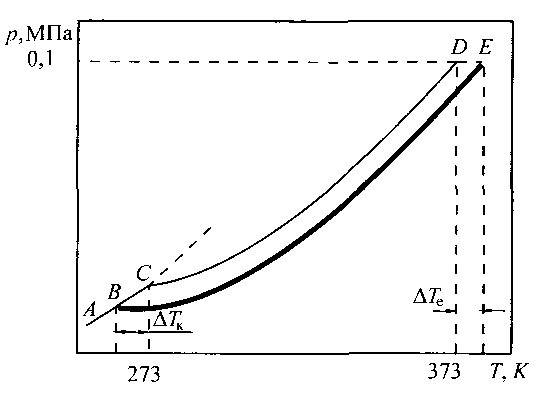 ри
кристалізації розчинів кристали
розчинника знаходяться в рівновазі
з розчином і тиск пари над кристалами
розчинника, і тиск пари над розчином
повинен бути однаковим.
ри
кристалізації розчинів кристали
розчинника знаходяться в рівновазі
з розчином і тиск пари над кристалами
розчинника, і тиск пари над розчином
повинен бути однаковим.
Рис.10. Залежність пружності насиченої пари води від температури над льодом (крива АС), водою (крива СД) і водним розчином (крива ВЕ)
На рис. 10 представлена фазова діаграма води, яка доповнена кривою О′В′, що характеризує тиск пари води над розчином нелеткої речовини. Ця крива розташовується нижче кривої ОВ – кривої тиску насиченої пари чистої води.
В точці О′ тиск пари льоду дорівнює тиску пари над розчином. Температура, що відповідає цій точці, буде температурою замерзання розчину (Тзам.).
Розчин замерзає при більш низьких температурах, ніж чистий розчинник. Із збільшенням концентрації розчину температура замерзання знижується.
Вивчаючи замерзанні і кипіння розчинів, Рауль встановив:
Підвищення температури кипіння і зниження температури замерзання розведених розчинів неелектролітів пропорційне моляльній концентрації розчину.
ΔТзам = Кзам∙m (2.3)
де m - моляльна концентрація розчину, моль/кг;
Кзам - кріоскопічна стала.
Якщо прийняти m = 1, то Тзам = Кзам. Отже, коефіцієнт Кзам дорівнює зниженню температури замерзання розчину, в якому на 1 моль розчиненої речовини приходиться 1 кг розчинника. Для кожного розчинника цей коефіцієнт постійний і не залежить від природи розчиненої речовини. Її називають кріоскопічною сталою (від грецьк. “кріос” – холод). Кріоскопічна стала води Кз Н2О = 1,86.
Кріоскопічна стала розчинника або молярне зниження температури замерзання чисельно дорівнює зниженню температури замерзання в одномолярному розчині з властивостями ідеального.
Метод вивчення властивостей розчинів, оснований на вимірюванні температури їх замерзання, був розроблений Бекманом і одержав назву кріоскопії.
Розчин кипить при температурі більш вищий, ніж чистий розчинник. Із збільшенням концентрації розчину температура кипіння підвищується.
Підвищення температури кипіння прямо пропорційне його молярності m:
ΔТкип = Ккип m (2.4)
Коефіцієнт Ккип - ебуліоскопічна стала (віл лат. “ебуліо” – кипіти). Ебуліоскопічна стала залежить тільки від природи розчинника і не залежить від природи розчиненої речовини.
Одномалярний розчин будь-якого неелектроліта у воді при нормальному атмосферному тиску буде кипіти при 100, 513 оС, тобто ебуліоскопічна стала воли Кн2Окип. = 0,513о.
Ебуліоскопічна стала розчинника або молярне підвищення температури кипіння чисельно дорівнює ΔТкип при моляльній концентрації 1моль/кг, якщо розчин при цій концентрації має властивості ідеального.
Метод дослідження властивостей розчинів, оснований на визначенні температури їх кипіння, називається ебуліоскопією.
Константи Ккип і Кзам постійні для кожного розчинника і не залежать від природи розчиненої речовини (табл.1.6)
На зміні пониження температури замерзання або підвищення температури кипіння оснований один з методів визначення відносної молекулярної маси. Рівняння (2.3) і (2.4) можна записати в загальному вигляді:
ΔТ = К m
Молярність розчину розраховують за формулою:
m
=
![]() .
1000,
.
1000,
де g- маса розчиненої речовини, г;
L - маса розчинника, г;
M – молекулярна маса розчиненої речовини.
Тоді об’єднавши цих два рівняння, матимемо:
ΔТ
=
![]() .
1000 або М =
.
1000 або М =
![]() .
1000 (2.5)
.
1000 (2.5)
Таким чином, за рівнянням (2.5) можна розраховувати відносну молярну масу розчиненої речовини, якщо відомо пониження температури замерзання або підвищення температури кипіння розчину певної концентрації.
На зниженні температури замерзання рідин при розчиненні в них нелетких речовин заснована дія антифризів.
Антифризи – речовини, додавання яких знижує температуру замерзання розчину.
Завдяки тому, що температура замерзання розчинів нижча, ніж температура замерзання ідеальних рідин, розчини використовують в якості хладоносіїв – рідин, які охолоджують до низьких температур і подають по трубам до місця споживання холоду.
Для цієї мети використовують розчини NaCl, CaCl2, етиленгліколю, але вони викликають корозію труб. Тому найкраще використовувати водні розчини пропиленгліколю, їх температура замерзання нижча – 50оС і вони мають корозійної активності.
Такі біологічні рідини, як молоко і кров, які є багатокомпонентними розчинами, замерзають при температурі нижче 0оС. Температура замерзання нормального коров’ячого молока знаходиться в межах від (-0,54) до (-0,58)оС. Відхилення від цієї температури вказує на розведення молока водою.
Таблиця 1.6
