
- •Тема 1.1. Основи хімічної термодинаміки . . . . . . . . . . . . . . . . . . . . . . 7
- •Тема 1.2. Фазова рівновага та вчення про розчини. . . . . . . . . . . . ..27
- •Тема 1.3 Електрохімія. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .47
- •Тема 1.1. Основи хімічної термодинаміки план
- •1. Зміст та основні поняття термодинаміки
- •2. Перше начало термодинаміки. Ентальпія
- •3. Закон гесса
- •Наслідки закону Гесса
- •Кількість енергії, що витрачається різними категоріями людей
- •4. Друге начало термодинаміки
- •5. Термодинамічні потенціали і фактори
- •Типи реакцій та умови їх протікання в залежності від
- •6. Розрахунок термодинамічних потенціалів в хімічних реакціях
- •Термодинамічні властивості деяких речовин
- •Тим, хто хоче знати більше Термодинаміка біохімічних процесів
- •Контрольні запитання
- •Тема 1.2. Фазова рівновага та вчення про розчини план:
- •1. Загальна характеристика розчинів
- •2. Розчини газів в рідинах. Закон генрі
- •Розчинність газів у воді при різних температурах, м3 газу/м3 води
- •Розчинність твердих речовин в рідинах
- •4. Дифузія і осмос в розчинах. Закон вант-гоффа
- •Явище осмосу. Закон вант - гоффа
- •Практичне значення осмосу
- •5. Тиск пари над розчинами. Закон рауля
- •6. Температура кристалізації і кипіння розчинів
- •Кріоскопічні і ебуліоскопічні сталі для деяких розчинників
- •7. Фазові переходи. Фазова рівновага
- •Класифікація гетерогенних систем
- •Тим, хто хоче знати більше розчинники, їх характеристика
- •Контрольні запитання.
- •Тема 1.3. Електрохімія електрична провідність розчинів. План
- •Предмет електрохімії
- •2. Електропровідність розчинів електролітів,
- •Вимірювання електропровідності
- •3. Електродний потенціал. Рівняння нернста
- •Ряд стандартних електродних потенціалів
- •С тандартні електродні та окисно-відновні потенціали у водних розчинах при 298к
- •4. Класифікація електродів
- •Класифікація електродів
- •Тим, хто хоче знати більше електрохімічні елементи
- •Контрольні запитання:
- •Тема 1.4. Хімічна кінетика і каталіз план
- •1.1. Природа речовин, що реагують
- •1.2. Агрегатний стан речовин
- •1.3. Площа поверхні зіткнення речовин, що реагують
- •1.4. Вплив тиску
- •1.5. Концентрація реагуючих речовин
- •2. Залежність швидкості реакції від температури
- •3. Складні реакції. Ланцюгові реакції
- •Ланцюгові реакції
- •4. Фотохімічні реакції
- •Каталіз і каталізатори
- •Ферментативний каталіз
- •Тим, хто хоче знати більше вплив температури на швидкість біологічних процесів
- •Література
4. Дифузія і осмос в розчинах. Закон вант-гоффа
Якщо в стакан із зафарбованим розчином якої-небудь речовини обережно влити розчинник, то на початку між шарами розчину і розчинника буде спостерігатися чітка межа розподілу.
Поступово межа розділу розмивається і через деякий час весь об'єм рідини набуває рівномірного зафарбування. Це відбувається в наслідок дифузії.
Д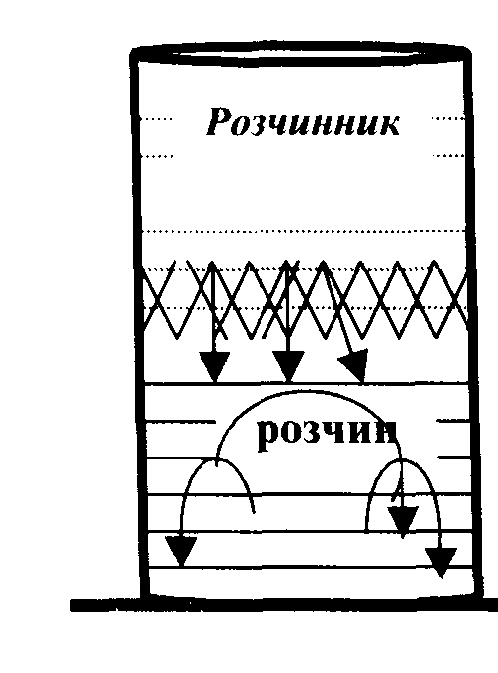 ифузія
-
самовільний переніс рідини з області
з більшою концентрацією в область з
меншою концентрацією, або
іншими словами
це самовільний процес вирівнювання
концентрацій.
ифузія
-
самовільний переніс рідини з області
з більшою концентрацією в область з
меншою концентрацією, або
іншими словами
це самовільний процес вирівнювання
концентрацій.
В наведеному прикладі розчинена речовина з нижнього шару дифундує в шар чистого розчинника, а молекули розчинника переходять в шар розчину, де концентрація їх менше. Цей процес двосторонньої дифузії закінчиться вирівнюванням концентрації в усьому об'ємі.
Швидкість дифузії вимірюється кількістю речовини, що переноситься за одиницю часу через одиницю площі.
Рис. 6. Процес дифузії через мембрану
Вона пропорційна різниці концентрації в двох шарах рідини і температурі. Чим більша різниця концентрації і чим вища температура, тим швидкість дифузії більша. По мірі вирівнювання концентрації швидкість дифузії зменшується.
Дифузія може йти в тому випадку, якщо між шаром розчину і шаром розчинника помістити напівпроникну перегородку - мембрану. Напівпроникними перегородками для водних розчинів можуть бути природні плівки, стінки кліток, а також плівки, одержані штучним шляхом (целофан, пергамент). Через ці плівки можуть проходити молекули розчинника і не проходять молекули розчиненої речовини. Такі плівки називаються напівпроникними мембранами.
Дифузія відіграє значну роль в життєдіяльності організмів і технологічних процесах. Так, процес переміщення різних поживних речовин і продуктів обміну в живих організмах пов’язаний з дифузією. В технології харчування з дифузією мають справу при вимочуванні риби, заварюванні чаю, кави. Такі процеси, як варка, пасерування, припускання також є практичним застосуванням дифузії.
Явище осмосу. Закон вант - гоффа
Одностороння дифузія розчинника в розчин через напівпроникну мембрану в зону з більшою концентрацією називається осмосом.
Об'єм розчину в результаті осмосу збільшується, при цьому виникає тиск на стінки посудини, в якому знаходиться розчин. Цей тиск називається осмотичним. Осмотичний тиск можна виміряти за допомогою приладу - осмометра. Основною частиною осмометра є посудина 1 з напівпроникного матеріалу 3, який заповнюється розчином 2 і розташовується в ємкості 4 з розчинником. В результаті осмосу об'єм розчину посудині 1 буде збільшуватися і він почне підніматися по вертикальній трубці. Тиск стовпа рідини (гідростатичний тиск) що визначається висотою h, перешкоджає осмосу.
Коли гідростатичний тиск вирівнюється з осмотичним тиском настає рівновага. По висоті підйому рідини в трубці можна розрахувати гідростатичний тиск, що дорівнює в даному випадку осмотичному тиску.
Осмотичний тиск залежить від концентрації розчину і температури. Для розбавлених розчинів неелектролітів ця залежність виражається рівнянням Вант-Гоффа.
![]() =
=
![]() = CRT, бо С = n/v
= CRT, бо С = n/v
де: - осмотичний тиск, Па;
n - кількість розчиненої речовини ( моль);
Т- абсолютна температура;
V - об'єм розчину;
R - постійна, прийнята рівною універсальній газовій сталій;
R = 8,314 • 103 Дж/(моль∙К).
Р ис.7.
Схема осмометра:
ис.7.
Схема осмометра:
1 – манометр; 2 – розчин; 3 – напівпроникна перегородка; 4 – розчинник.
Співвідношення рівняння Вант — Гоффа по формі з рівнянням стану ідеального газу Клапейрона - Менделєєва дозволило зробити заключення, що осмотичний тиск розбавленого розчину дорівнює тому тиску, який необхідно прикласти до розчину, щоб привести його в рівновагу з чистим розчинником, що відокремлений від нього напівпроникною перегородкою. Це заключення і є законом Вант - Гоффа. Закон Вант-Гоффа справедливий не для всіх розчинів. Розчини електролітів (солей, кислот, основ) мають більш високий осмотичний тиск, ніж розрахований за рівнянням Вант-Гоффа.
Розчини, що мають однаковий осмотичний тиск називають ізотонічними.
Для таких розчинів Вант-Гофф ввів в це рівняння коефіцієнт і, що називається ізотонічним коефіцієнтом: П експ = і СRТ
Звідки
і
=
![]()
Ізотонічний коефіцієнт показує в скільки разів експериментальна розрахований осмотичний тиск П експ. більший розрахованого П розрах.
