
- •Основы молекулярно-кинетической теории Понятие о молекулярно-кинетической теории строения вещества и ее опытные основания
- •Газовое состояние вещества Характер молекулярного движения и сил взаимодействия в газах Идеальный газ
- •Основные газовые законы: Бойля–Мариотта,Шарля, Гей–Люссака
- •Уравнение состояние идеального газа (уравнение Клапейрона- Менделеева)
- •Распределение молекул газа по скоростям
- •Термодинамика
- •Внутренняя энергия термодинамической системы
- •Теплота и работа. Первый закон термодинамики
- •Применение первого начала термодинамики к газовым процессам Механическая работа в изопроцессах
- •Теплоемкость газов
- •Адиабатный процесс
- •Недостаточность первого закона термодинамики. Обратимые и необратимые процессы. Формулировки второго начала термодинамики
- •Круговые процессы (циклы). Тепловая машина. Цикл Карно. Кпд тепловой машины
- •Приведенная теплота. Энтропия.
- •Свойства энтропии
Распределение молекул газа по скоростям
Молекулы газа движутся с самыми различными скоростями, причем численное значение скорости и ее направление все время меняется. В результате при отсутствии внешних воздействий распределение молекул по направлениям будет равномерным, т.к. каждое направление равновероятно.
Другое дело с численными значениями скоростей. Возможные значения скоростей. Заключенных в пределах от нуля до бесконечности, далеко не равновероятны. Дело в том,что скорость равная бесконечности вообще не может иметь места, ибо даже если все молекулы отдадут свою энергию одной молекуле, а сами остановятся, то и в этом случае скорость молекулы будет максимально большой, но не бесконечно большой.
Значит скорость
молекул газа не может принимать значений
с некоторого
![]() до бесконечности.
до бесконечности.
Т.к. такой процесс совершенно маловероятен, то можно утверждать, что как слишком большие скорости по сравнению со средним значением, так и очень малые значения , будут маловероятны.
Совершенно понятно, что среди огромного числа молекул будут группы молекул с одинаковыми скоростями.
Встает вопрос, каким же образом определить, сколько молекул, имеющих одинаковую скорость приходится на одинаковый интервал.
Английский физик
Дж. Максвелл в 1860 г., применив к тепловому
хаотическому движению молекул законы
теории вероятностей и математической
статистики получил закон, который
называют закон
максвелловского распределения молекул
по скоростям.
Этот закон описывается некоторой
функцией
распределения молекул по скоростям.
Суть закона сводится к следующему. Если
разбить весь диапазон скоростей молекул
на малые, но одинаковые интервалы, равные
![]() ,
то на каждый интервал скорости будет
приходиться некоторое число молекул
,
то на каждый интервал скорости будет
приходиться некоторое число молекул
![]() ,
имеющих скорость
,
имеющих скорость
![]() ,
заключенную в этом интервале.
,
заключенную в этом интервале.
Функция
![]() определяет
относительное число молекул
определяет
относительное число молекул
![]() ,скорости которых лежат в интервале от
,скорости которых лежат в интервале от
![]() до
до
![]() .
.
![]() , (36)
, (36)
Конкретный вид функции зависит от рода газа (от массы молекулы) и от параметров состояния (температуры). График распределения функции по скоростям имеет вид, изображенный на рисунке 8.
Ф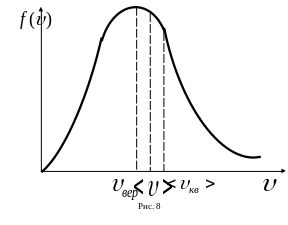 ункция
распределения удовлетворяет условию
нормиро-вания:
ункция
распределения удовлетворяет условию
нормиро-вания:
![]()
Вся площадь
под кривой равна единице.
Тогда относительное
число молекул
,
скорости которых лежат в интервале от
до
![]() находится
на графике, как площадь фигуры с основанием
,
расположенном на оси соответствующей
скорости.
находится
на графике, как площадь фигуры с основанием
,
расположенном на оси соответствующей
скорости.
Кривая не симметрична относительно максимума кривой. Максимум функции распределения соответствует скорости, называемую вероятной.
![]() ,
или
,
или
![]() ,
(38)
,
(38)
Можно отметить, что число молекул, у которых скорость всего в три раза больше вероятной соответствует 0,04% от общего числа молекул, а скорости, превышающие наиболее вероятную в пять раз, наблюдаются у одной из12 миллиардов молекул. Именно это и позволяет в ряде случаев не учитывать разброса в скоростях и считать, что скорости молекул в основном группируются вблизи вероятной и зависит только от температуры и молярной массы газа.
Кроме вероятной и квадратичной скорости в ряде процессов используется средняя арифметическая скорость.
![]() ,
или
,
или
![]() , (39)
, (39)
При изменении температуры значение максимума функции распределения и вероятной скорости меняется. Значения средней арифметической скорости и среднеквадратичной скорости больше чем вероятной скорости , но их функция распределения меньше
Проведенные эксперименты полностью подтвердили распределение Максвелла, полученное теоретически.
