
- •Основы молекулярно-кинетической теории Понятие о молекулярно-кинетической теории строения вещества и ее опытные основания
- •Газовое состояние вещества Характер молекулярного движения и сил взаимодействия в газах Идеальный газ
- •Основные газовые законы: Бойля–Мариотта,Шарля, Гей–Люссака
- •Уравнение состояние идеального газа (уравнение Клапейрона- Менделеева)
- •Распределение молекул газа по скоростям
- •Термодинамика
- •Внутренняя энергия термодинамической системы
- •Теплота и работа. Первый закон термодинамики
- •Применение первого начала термодинамики к газовым процессам Механическая работа в изопроцессах
- •Теплоемкость газов
- •Адиабатный процесс
- •Недостаточность первого закона термодинамики. Обратимые и необратимые процессы. Формулировки второго начала термодинамики
- •Круговые процессы (циклы). Тепловая машина. Цикл Карно. Кпд тепловой машины
- •Приведенная теплота. Энтропия.
- •Свойства энтропии
Уравнение состояние идеального газа (уравнение Клапейрона- Менделеева)
На практике преобладают изменения состояния газа, когда меняются не два параметра, а сразу все три параметра.
Закон, описывающий такие процессы, был установлен в 1834 г. Клапейроном на основании эмпирических законов Бойля–Мариотта и Шарля.
П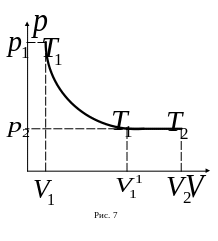 редположим,
что имеется некоторая масса газа
редположим,
что имеется некоторая масса газа
![]() с
исходными параметрами состояния
с
исходными параметрами состояния
![]() и необходимо перевести газ в состояние
с параметрами
и необходимо перевести газ в состояние
с параметрами
![]() (рис. 7). Переводим газ из первого состояния
в новое промежуточное газовое состояние
с параметрами
(рис. 7). Переводим газ из первого состояния
в новое промежуточное газовое состояние
с параметрами
![]() сначала через изотермический процесс,
оставляя постоянной температуру
сначала через изотермический процесс,
оставляя постоянной температуру
![]() и изменяя объем газа до значения
и изменяя объем газа до значения
![]() .
Используя формулу изотермического
процесса получаем
.
Используя формулу изотермического
процесса получаем
![]() ,
(10)
,
(10)
Графическое изображение процессов представлено на чертеже.
Объединяя формулы (10) и (11), получаем
Затем, используя
изобарный процесс ,переводим газ из
состояния с параметрами
![]() в состояние с параметрами
в состояние с параметрами
![]()
![]() , (11)
, (11)
![]() , (12)
, (12)
Написанная закономерность справедлива не только, когда одно из состояний соответствует нормальным условиям, но и для любого состояния данной массы газа и значит
![]() это
уравнение Клапейрона, (13)
это
уравнение Клапейрона, (13)
Т. к. при данном
давлении и температуре объем газа
пропорционален массе газа, то и отношение
![]() должно быть пропорционально массе, а,
следовательно, числу молекул
должно быть пропорционально массе, а,
следовательно, числу молекул
![]() в газе:
в газе:
![]() , (14)
, (14)
где k–
постоянная Больцмана (![]() Дж/К).
Дж/К).
Число молекул в
газе получим, используя число молей
газа
![]() и
число Авогадро:
и
число Авогадро:
![]() , (15)
, (15)
Подставляя (15) в (14) получаем:
![]()
![]() , (16)
, (16)
Произведение
![]() Дж/(моль∙К) называют
универсальной газовой постоянной.
Дж/(моль∙К) называют
универсальной газовой постоянной.
Тогда окончательно уравнение (16) принимает вид
![]() , (17)
, (17)
Которое и называют уравнением состояния идеального газа или уравнение Клапейрона–Менделеева.
Универсальная газовая постоянная имеет вполне определенный физический смысл: она численно равна работе расширения одного моля газа при его нагревании на один градус при постоянном давлении.
1 моль газа равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде –12 массой 0,012 кг.
Основное уравнение молекулярно-кинетической теории газов
С молекулярно- кинетической точки зрения давление газа на стенки сосуда обусловлено ударами молекул о них и должны быть связаны с величинами, определяющими движение отдельных молекул (их массами и скоростями).
Для установления
такой связи представим, что в сосуде
находятся молекулы одноатомного газа,
имеющие различные скорости
![]() .
.
Пренебрегая полем
тяготения, каждая молекула при ударе о
стенку сосуда действует на нее с силой,
зависящей от нормальной составляющей
скорости. Любая скорость может быть
разложена на три компоненты, соответствующие
проекции этой результирующей скорости
на соответствующую ось. Так, например,
скорость молекулы
![]() представляется
представляется
![]() , (18)
, (18)
Т.о. если ось Х
перпендикулярна стенке сосуда, то для
молекулы массой
![]() , подлетающей к стенке со скоростью
, подлетающей к стенке со скоростью
![]() и испытавшей абсолютно упругое
столкновение, можно написать, что
и испытавшей абсолютно упругое
столкновение, можно написать, что
![]() , (19)
, (19)
Если в направлении
оси Х в обе стороны движутся молекулы
имеющие скорость
, то за время
![]() об эту стенку площадью S
ударятся все молекулы, находящиеся в
объеме c
основанием S
и высотой
об эту стенку площадью S
ударятся все молекулы, находящиеся в
объеме c
основанием S
и высотой
![]() .
Общий импульс силы запишется следующим
образом
.
Общий импульс силы запишется следующим
образом
![]() , (20)
, (20)
или
![]() , (21)
, (21)
где
![]() число
молекул в единице объема (концентрация),
имеющих скорость
.
Величина ½ в уравнении (2) отражает тот
факт, что количество молекул, движущихся
вдоль оси Х в направлении стенки равно
половине от всех молекул по этой оси.
число
молекул в единице объема (концентрация),
имеющих скорость
.
Величина ½ в уравнении (2) отражает тот
факт, что количество молекул, движущихся
вдоль оси Х в направлении стенки равно
половине от всех молекул по этой оси.
Тогда давление, оказываемое эти ,,сортом” молекул
![]() , (22)
, (22)
Аналогично для других молекул перемещающихся вдоль этой оси
![]() ,
,
![]() ,… (23)
,… (23)
Сложив левые и правые части последних двух уравнений получим
![]() , (24)
, (24)
Разделим последнее
уравнение на
![]() –
общее число молекул в единице объема
(
–
общее число молекул в единице объема
(![]() )
)
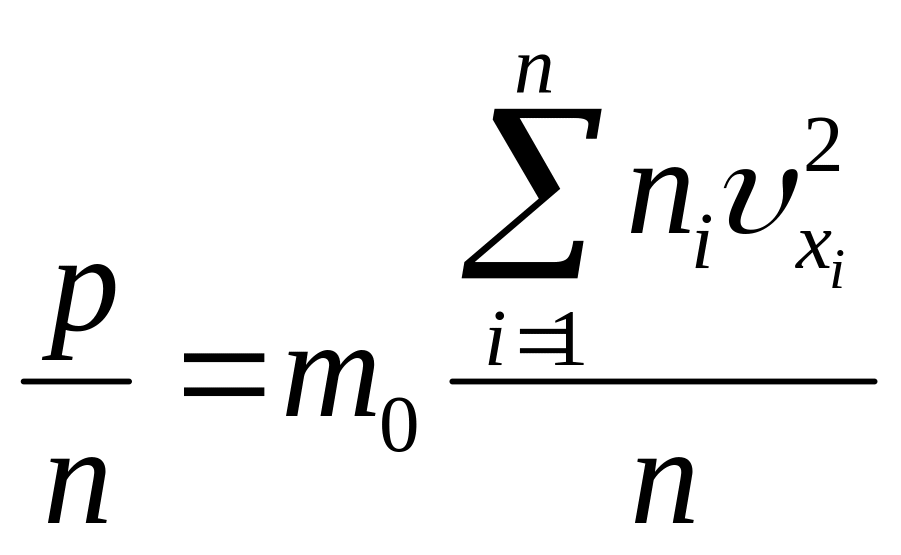
Величина
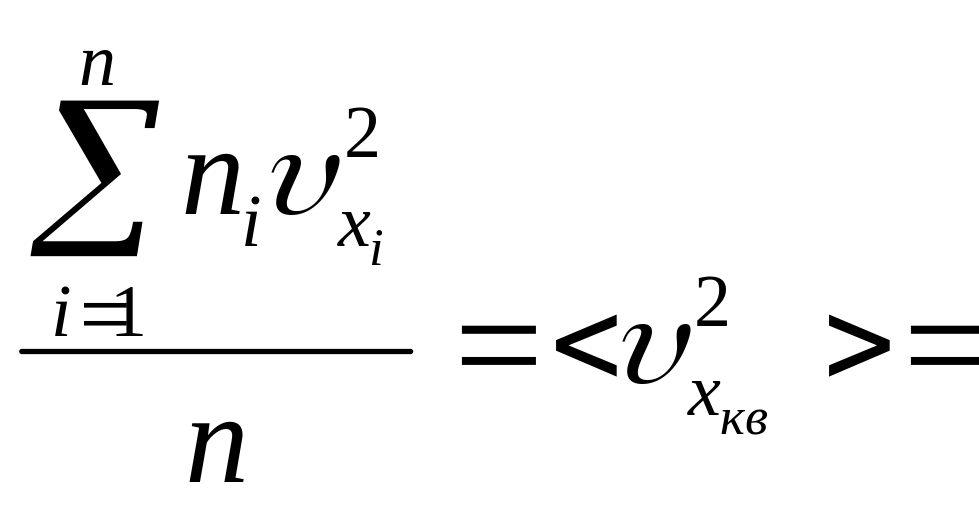
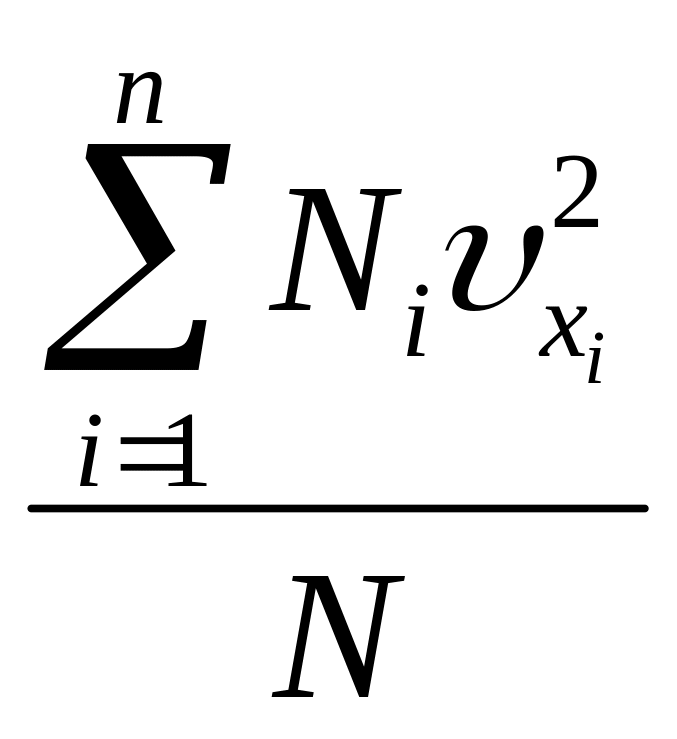 представляет некоторое среднее значение
квадратов компонент скоростей вдоль
оси Х.
представляет некоторое среднее значение
квадратов компонент скоростей вдоль
оси Х.
Тогда получаем
![]() , (25)
, (25)
Использование последнего уравнения затруднено тем, что в него входит не полная компонента молекулярной скорости, а ее компонента по оси х.Однако можно написать следующую систему уравнений
![]()
……………………….
![]()
Умножим левую и правую части каждого уравнения на число молекул, соответствующих скоростям и сложим левые и правые части:
![]() ,(26)
,(26)
Разделим левую и правую части уравнения на общее число молекул.
Тогда получим
![]() , (27)
, (27)
Т.к. при хаотическом движении нет преимущественных направлений и все они равновероятны, то можно написать, что
![]() , (28)
, (28)
С учетом этого
получаем
![]() и подставляя это в (25)
и подставляя это в (25)
Получаем окончательный вид основного уравнения кинетической теории
![]() , (29)
, (29)
Из него вытекает
![]() , (30)
, (30)
Но величина
![]() это
средняя кинетическая энергия
поступательного движения молекулы. С
учетом этого уравнение (30) приобретает
вид
это
средняя кинетическая энергия
поступательного движения молекулы. С
учетом этого уравнение (30) приобретает
вид
![]() , (31)
, (31)
Это уравнение Клаузиуса.
Умножим левую и
правую части уравнения (31) на объем
одного моля газа
![]() :
:
![]() ,
в котором
,
в котором
![]() число Авогадро,
число Авогадро,
а
![]() .
Тогда
.
Тогда
![]() ,
а отношение
,
а отношение
![]()
В результате получаем, что энергия поступательного движения молекулы выражается через температуру:
![]() , (32)
, (32)
Определение температуры как параметра состояния газа должно основываться на такой физической величине, которая автоматически определяет состояние системы. Ею и является средняя кинетическая энергия поступательного движения молекулы
![]() ,
,
Заменяя в уравнении (31) получаем зависимость давления от температуры
![]() , (33)
, (33)
Используя формулу (32) можно получить формулу для среднеквадратичной скорости молекулы
![]()
Отсюда
![]() , (34)
, (34)
Если заменить
постоянную Больцмана, а масса молекулы
![]()
то
![]() , (35)
, (35)
