
- •Вопрос 4.Типы термодинамических систем. Определение системы. Какими термодинамическими параметрами характеризуется состояние системы.
- •Вопрос 8 Фосфор . Степени окисления. С какими атомами фосфор образует наиболее прочные связи. Фосфиды. Оксиды. Кислоты фософра. Гидрофосфаты и дигидрофосфаты
- •Вопрос 10
- •Вопрос 11
- •Вопрос 12.Сера. Степени окисления. Оксиды. Сульфиды. Кислоты. Амфотерные сульфиды (гидролиз).
- •Вопрос 13
- •Вопрос 15 Физиологический раствор. Гемолиз.Направление окислительно-восстановительных реакций.
- •Вопрос 16
- •Вопрос 17 Приведите уравнение, по которому можно вычислить молярные массы газов?
- •Вопрос 18 Почему у атома кальция сначала заселяется 4s-орбиталь, а не 3d ? Четвертый период, как и следует, начинается с щелочного металла
- •Вопрос 19
- •Вопрос 20 Энтропия. Второе начало термодинамики.
- •Вопрос 25
- •Вопрос 26. Какое давление называется парциальным? Закон парциальных давлений.
- •Вопрос 27
- •Вопрос 30. Напишите уравнение Нернста для окислительно-восстановительной реакции:
- •Вопрос 31.Какие орбитали называются вырожденными? Чем определяется кратность вырождения? Приведити примеры.
- •Вопрос 32.Направление химических реакций. Как изменяется энтропия при повышение температуры? Как изменяется энтропия при переходе из твердого состояния в жидкое?
- •Вопрос 33.Скорость химической реакции. Активные молекулы, энергия активации. Влияние температуры на скорость химической реакции (правило Вант-Гоффа).
- •Вопрос 42. Гомогенные и гетерогенные химические реакции.
- •Вопрос 43 .Степень диссоциации. Сильные и слабые электролиты. Как зависит степень диссоциации от концентрации растворов.
- •Вопрос 44.Окислительно-восстановительные реакции. Роль среды. Направление реакций окисления-восстановления.
- •Вопрос 45Теория кристаллического поля
- •Вопрос 46 Бор. Отношение к кислотам и щелочам. Оксид и гидроксид. Борная кислота.
- •Вопрос 47
- •Вопрос 48 Постулаты Бора. В чем противоречие теории Бора
- •Вопрос 50 Чему равно изменение энтропии. Необратимые процессы. Причина необратимости.
Вопрос 47
HClO4 — тетраоксохлорат(VII) водорода (хлорная кислота)
HClO3 — триоксохлорат(V) водорода (хлорноватая кислота)
HClO2 — диоксохлорат(III) водорода (хлористая кислота)
HClO — оксохлорат(I) водорода (хлорноватистая кислота)
НСlOn (n = 1— 4)
Рассмотрим структурные формулы этих кислот:
![]() Хлорноватистая
Хлорноватистая
![]() Хлористая
Хлористая
 Хлорноватая
Хлорноватая
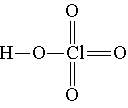 Хлорная
Хлорная
Для диссоциации по кислотному типу необходим разрыв связи О—Н. Как можно объяснить уменьшение прочности этой связи в ряду НСlO — HClO2 — НClO3 — НClO4? В этом ряду увеличивается число атомов кислорода, связанных с центральным атомом хлора. Каждый раз, когда образуется новая связь кислорода с хлором, от атома хлора, а следовательно, и от первичной связи О—С1 оттягивается некоторая доля электронной плотности. В результате этого часть электронной плотности оттягивается и от связи О—Н, которая за счет этого ослабляется.
Такая закономерность — усиление кислотных свойств с возрастанием степени окисления центрального атома — характерна не только для хлора, но и для других элементов. Например, азотная кислота HNO3, в которой степень окисления азота равна 5+, является более сильной кислотой, чем азотистая кислота HNO2 (степень окисления азота 3+); серная кислота H2SO4 (S6+) — более сильная, чем сернистая кислота Н2SО3 (S4+).
Вопрос 48 Постулаты Бора. В чем противоречие теории Бора
Постулаты Бора. В чем противоречие теории Бора. (стр.43-45 по Глинке)
1. электрон вращается только по стационарным орбитам.
2. двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии.
3. излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергии атома в конечном и исходном состоянии.
П. Бора находились в резком противоречие с законом классической физики. С точки зрения классической механики электрон может вращаться по любым орбитам, а классич. электродинамика не допускает движения заряженной частицы по круговой орбите без излучения.
Постулаты Б. запрещают промежуточное состояние, т. к. постулируется возможность пребывание электрона только на стационарных орбитах.
Эта теория не могла объяснить некоторых важных спектральных характеристик многоэлектронных атомов и даже атома водорода.
в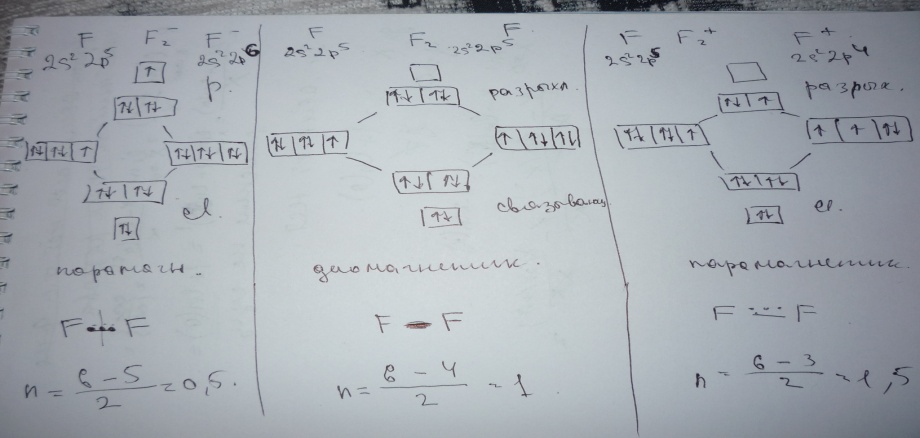 опрос
49 Энергетическая диаграмма
МО молекулы фтора.
опрос
49 Энергетическая диаграмма
МО молекулы фтора.
Вопрос 50 Чему равно изменение энтропии. Необратимые процессы. Причина необратимости.
Изменение энтропии (обратимом процессе) это отношение общего количества тепла (∆Q ) к величине абсолютной температуры (T) (то есть тепло, переданное системе, при постоянной температуре):
![]() .
.
Необратимые процессы могут протекать самопроизвольно только в одном направлении.
Признаки необратимости реакции:
а) выделение большого количества Q (горение)
б) разложение веществ (газообразные вещества)
прим: CaCO3 → CO2↑+CaO
в) если образуются газообразные или нерастворимые продукты.
г) если р-ия протекает между сильными электролитами, а в продуктах образуется слабый электролит.
(необратимые реакции протекают до конца - до полного израсходования одного из реагирующих веществ.)
51 Влияние различных факторов на химическое равновесие, принцип Ле-Шателье.
Принцип Ле-Щателье: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
а) влияние температуры на хим равновесие:
при повышении t равновесие смещ. в сторону эндотермической (-Q) реакции,
при понижении t равн. смещ-ся в сторону экзотермической (+Q) реакции.
б) влияние изменения давления — только для газов. (прим реакции: N2+3H2⇌ 2NH3+Q)
При повышение давления р-ия смещается в сторону уменьшении числа молекул газа
при понижение давления р-ия смещается в сторону увеличения числа молекул газа
в) влияние изменения концентрации веществ:
при повышении концентрации вещества, р-ия смещается в ту сторону , где она расходуется.
