
- •Вопрос 4.Типы термодинамических систем. Определение системы. Какими термодинамическими параметрами характеризуется состояние системы.
- •Вопрос 8 Фосфор . Степени окисления. С какими атомами фосфор образует наиболее прочные связи. Фосфиды. Оксиды. Кислоты фософра. Гидрофосфаты и дигидрофосфаты
- •Вопрос 10
- •Вопрос 11
- •Вопрос 12.Сера. Степени окисления. Оксиды. Сульфиды. Кислоты. Амфотерные сульфиды (гидролиз).
- •Вопрос 13
- •Вопрос 15 Физиологический раствор. Гемолиз.Направление окислительно-восстановительных реакций.
- •Вопрос 16
- •Вопрос 17 Приведите уравнение, по которому можно вычислить молярные массы газов?
- •Вопрос 18 Почему у атома кальция сначала заселяется 4s-орбиталь, а не 3d ? Четвертый период, как и следует, начинается с щелочного металла
- •Вопрос 19
- •Вопрос 20 Энтропия. Второе начало термодинамики.
- •Вопрос 25
- •Вопрос 26. Какое давление называется парциальным? Закон парциальных давлений.
- •Вопрос 27
- •Вопрос 30. Напишите уравнение Нернста для окислительно-восстановительной реакции:
- •Вопрос 31.Какие орбитали называются вырожденными? Чем определяется кратность вырождения? Приведити примеры.
- •Вопрос 32.Направление химических реакций. Как изменяется энтропия при повышение температуры? Как изменяется энтропия при переходе из твердого состояния в жидкое?
- •Вопрос 33.Скорость химической реакции. Активные молекулы, энергия активации. Влияние температуры на скорость химической реакции (правило Вант-Гоффа).
- •Вопрос 42. Гомогенные и гетерогенные химические реакции.
- •Вопрос 43 .Степень диссоциации. Сильные и слабые электролиты. Как зависит степень диссоциации от концентрации растворов.
- •Вопрос 44.Окислительно-восстановительные реакции. Роль среды. Направление реакций окисления-восстановления.
- •Вопрос 45Теория кристаллического поля
- •Вопрос 46 Бор. Отношение к кислотам и щелочам. Оксид и гидроксид. Борная кислота.
- •Вопрос 47
- •Вопрос 48 Постулаты Бора. В чем противоречие теории Бора
- •Вопрос 50 Чему равно изменение энтропии. Необратимые процессы. Причина необратимости.
Вопрос 33.Скорость химической реакции. Активные молекулы, энергия активации. Влияние температуры на скорость химической реакции (правило Вант-Гоффа).
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Например для реакции:
![]()
выражение для скорости будет выглядеть так:
![]() .
.
В 1865 году Н. Н. Бекетовым и в 1867 году Гульдбергом и Вааге был сформулирован закон действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным степени, равные их стехиометрическим коэффициентам.
Для элементарных реакций показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
природа реагирующих веществ,
наличие катализатора,
температура (правило Вант-Гоффа),
давление,
площадь поверхности реагирующих веществ.
Если мы рассмотрим самую простую химическую реакцию A + B → C, то мы заметим, что мгновенная скорость химической реакции величина непостоянная.
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
-
При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.
Уравнение, которое описывает это правило следующее:
![]()
где ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
—
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
![]()
Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции:
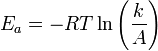
k —
константа скорости реакции, ![]() — фактор
частоты для реакции,
— фактор
частоты для реакции, ![]() — универсальная
газовая постоянная,
— универсальная
газовая постоянная, ![]() — температура в кельвинах.
— температура в кельвинах.
С повышением температуры растёт вероятность преодоления энергетического барьера.
Для количественного описания температурных эффектов в химической кинетике для приближённых вычислений кроме уравнения Аррениуса используют правило Вант-Гоффа: повышение температуры на 10 К увеличивает для большинства реакций скорость в 2-4 раза. Математически это означает, что скорость реакции зависит от температуры степенным образом:
![]()
где ![]() —
температурный коэффициент скорости
(его значение лежит в интервале от 2 до
4). Правило Вант-Гоффа является весьма
грубым и применимо только в очень
ограниченном интервале температур.
—
температурный коэффициент скорости
(его значение лежит в интервале от 2 до
4). Правило Вант-Гоффа является весьма
грубым и применимо только в очень
ограниченном интервале температур.
Переходное состояние — состояние системы, при котором уравновешены разрушение и создание связи. В переходном состоянии система находится в течение небольшого (10−15 с) времени. Энергия, которую необходимо затратить, чтобы привести систему в переходное состояние, называется энергией активации. В многоступенчатых реакциях, которые включают в себя несколько переходных состояний, энергия активации соответствует наибольшему значению энергии. После преодоления переходного состояния молекулы вновь разлетаются с разрушением старых связей и образованием новых или с преобразованием исходных связей. Оба варианта возможны, так как происходят с высвобождением энергии (это хорошо видно на рисунке, поскольку оба положения лежат энергетически ниже энергии активации). Существуют вещества, способные уменьшить энергию активации для данной реакции. Такие вещества называют катализаторами. Биологи же такие вещества называют ферментами. Интересно, что катализаторы таким образом ускоряют ход реакции, самостоятельно в ней не участвуя.
Вопрос 34
 умноженного
на молярную долю его раствора.
умноженного
на молярную долю его раствора.
Вопрос 35
Вопрос 36
Вопрос 37
Вопрос 38
Вопрос 39 Из трех способов распределения валентных электронов выберите вариант, который не соответствует принципу Паули:

Вопрос 40 Какие взаимодействия относятся к Ван-дер-ваальсовым силам? Расположите их в порядке убывания энергии взаимодействия.
Силы Ван-дер-Ваальса - универсальные межмолекулярные взаимодействия, которые проявляются во всех молекулах без исключения ( их энергия не превышает 8 кДж/моль ), они являются первой причиной перехода большинства веществ из газообразного состояния в жидкое, устойчивости молекулярных кристаллов и др. явлений.
Дипольное притяжение
Индукционное притяжение
Дисперсионное притяжение
Вопрос 41 Первое начало термодинамики. Работа. Энергия в изолированной системе.
Первое начало термодинамики.
Теплота, подведенная к системе, расходуется на изменении энергии и совершении работы против внешних сил.
Q =Δ Е + W, W – работа
Работой против внешних сил может быть работа механического линейного перемещения тела, работа поднятия тела в поле земного тяготения, работа расширения газа, работа поверхностного натяжения. Величина работы зависит от вида процесса и не является функцией состояния системы.
Энергия в изолированной системе не возникает и не исчезает, а лишь переходит из одной формы в другую в строго эквивалентных количествах, исходя из 1-го закона термодинамики, тепловой эффект прямой реакции равен по абсолютному значению и противоположному знаку тепловому эффекту обратной реакции.
