
- •Методические указания
- •Краткие теоретические сведения. Теплоемкость. Количество теплоты.
- •Краткие теоретические сведения Понятие о термодинамических процессах
- •Внутренняя энергия и работа расширения и сжатия рабочего тела
- •Первый закон термодинамики. Энтальпия газа
- •Краткие теоретические сведения Процессы изменения состояния идеального газа.
- •Краткие теоретические сведения
- •Понятие об энтропии газа и т—s-диаграмма
- •Краткие теоретические сведения Понятие о круговом процессе
- •Цикл Карно и его термодинамическое значение
- •Краткие теоретические сведения. Циклы двигателей внутреннего сгорания.
- •Краткие теоретические сведения Уравнение состояния для реальных газов
- •Рассмотрение процесса парообразования
- •Краткие теоретические сведения. Основы теории теплообмена Виды теплообмена
- •Теплопроводность
- •Конвективный теплообмен.
- •Краткие теоретические сведения. Лучистый теплообмен.
- •Сложный теплообмен.
- •Перечень рекомендуемой литературы
Краткие теоретические сведения
Сущность и формулировки второго закона термодинамики
Первый закон термодинамики позволяет судить о количественных соотношениях в процессах взаимопреобразований тепловой и механической энергий, но не устанавливает условия, при которых эти процессы происходят.
Формулировки условий, необходимых для преобразования одного вида энергии в другой, представляют собой второй закон термодинамики, который, таким образом, является весьма существенным дополнением первого закона. Оба закона термодинамики являются основой современной термодинамики.
Имеется несколько формулировок второго закона термодинамики. Приведем наиболее характерные:
для превращения теплоты в механическую работу необходимо иметь источник теплоты и холодильник с температурой ниже температуры источника, т. е. необходим температурный перепад;
нельзя осуществить тепловой двигатель, единственным результатом действия которого было бы превращение теплоты какого- либо тела в работу без передачи части теплоты другим телам;
теплота не может переходить от менее нагретого тела к более нагретому без совершения внешней работы.
Первые две формулировки относятся к двигателям, в которых теплота превращается в работу, третья формулировка определяет условия работы холодильных установок.
Понятие об энтропии газа и т—s-диаграмма
Рассмотрим
произвольный обратимый процесс на
![]() —
—![]() диаграмме, в котором к рабочему телу
подводится теплота и осуществляется
переход из состояния 1 в состояние 2
(рис.3). Если весь процесс разделить на
элементарные отрезки, то для каждого
из них количеств подведенной теплоты
диаграмме, в котором к рабочему телу
подводится теплота и осуществляется
переход из состояния 1 в состояние 2
(рис.3). Если весь процесс разделить на
элементарные отрезки, то для каждого
из них количеств подведенной теплоты
![]() можно считать бесконечно малой величиной,
а температуру рабочего тела постоянной,
равной Т. Отношение dq/Т
называется приведенной теплотой и
обозначается
можно считать бесконечно малой величиной,
а температуру рабочего тела постоянной,
равной Т. Отношение dq/Т
называется приведенной теплотой и
обозначается
![]() ,
т. е.
,
т. е.
![]() (1.7)
(1.7)
Изменение приведенной теплоты в процессе 1—2
![]()

![]() =
=![]() =
=![]()
![]()
Согласно уравнению первого закона термодинамики, числитель подынтегрального выражения
![]() Рис.
3. к пояснению понятия энтропии газа
Рис.
3. к пояснению понятия энтропии газа
Тогда
 (1.8)
(1.8)
Из уравнения
состояния идеального газа следует, что
![]() ,
,
откуда
 .
.
После интегрирования получим
![]() .
(1.9)
.
(1.9)
Величина
называется энтропией.
Из уравнения (1.9) видно, что изменение
энтропии зависит только от начальных
и конечных параметров состояния рабочего
тела и, следовательно, энтропия сама
является параметром состояния.
Уравнение (1.9) определяет связь энтропии
с параметрами
![]() и
,
т.е.
и
,
т.е.
![]() .
.
Из уравнения состояния идеального газа, написанного для состояний 1 и 2, имеем
![]() ;
;
![]() .
.
Тогда
![]()
Подставив выражения для этих отношений в уравнение (1.9) и используя уравнение Майера, получим еще два уравнения связи энтропии с параметрами состояния рабочего тела, т. е. уравнения вида
![]() и
и
![]()
![]() :
:
![]() ;
(1.10)
;
(1.10)
![]() (1.11)
(1.11)
Параметр «энтропия» используют при изучении тепловых процессов и выполнении различных теплотехнических расчетов. По изменению энтропии можно судить о направлении тепловых потоков.
Из уравнения (1.7) следует, что знаки приращения энтропии и теплоты совпадают. Действительно, если ds > 0, то dq> 0, так как температура Т всегда положительна; если же ds < 0, то и dq < 0. Таким образом, если в процессе изменения состояния рабочего тела энтропия уменьшается, то это значит, что теплота отводится от рабочего тела, и, наоборот, если энтропия возрастает, то теплота к рабочему телу подводится.
Для определения
количества теплоты, затраченной в каком-
либо термодинамическом процессе,
производят построение этого процесса
на Т—s
диаграмме, где по оси ординат отложена
температура Т, а по оси абсцисс — энтропия
s
(рис. 4). Если для процесса 1—2 известна
зависимость Т=f(s),
то площадь 1—2—3— 4—1 будет равна
![]()
Следовательно, на Т— s-диаграмме площадь под кривой процесса изменения состояния рабочего тела численно равна количеству теплоты процесса.
Определим
![]() для
рассмотренных ранее основных
термодинамических процессов.
для
рассмотренных ранее основных
термодинамических процессов.
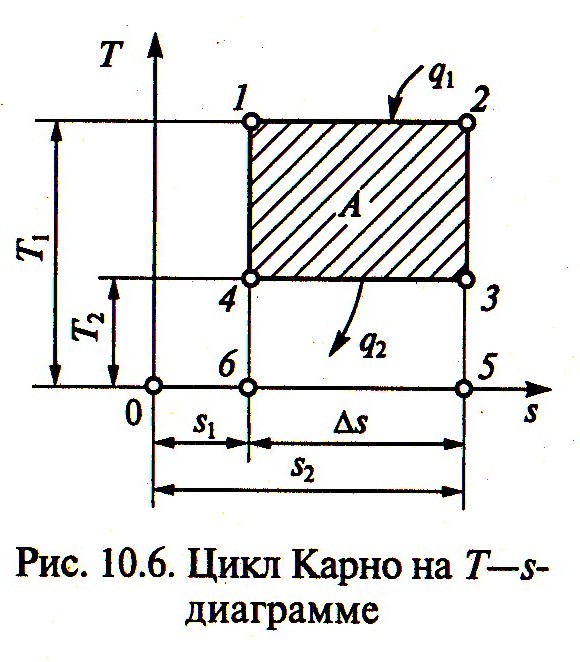
Их графическое изображение на Т—s-диаграмме показано на рис. 5.
Для изохорного
процесса (![]() )
выражение (1.9) принимает вид
)
выражение (1.9) принимает вид
![]() (1.12)
(1.12)
В координатах Т—s
это логарифмическая кривая, направленная
выпуклостью к оси абсцисс. Отрезок
кривой
![]() отображает нагревание газа, так как,
отображает нагревание газа, так как,
![]() >0,
>0.
Отрезок
>0,
>0.
Отрезок
![]() соответствует
отводу теплоты и охлаждению газа.
соответствует
отводу теплоты и охлаждению газа.
Для изобарного
процесса (![]() )
из уравнения (1.10)
)
из уравнения (1.10)
Имеем
![]() (1.13)
(1.13)
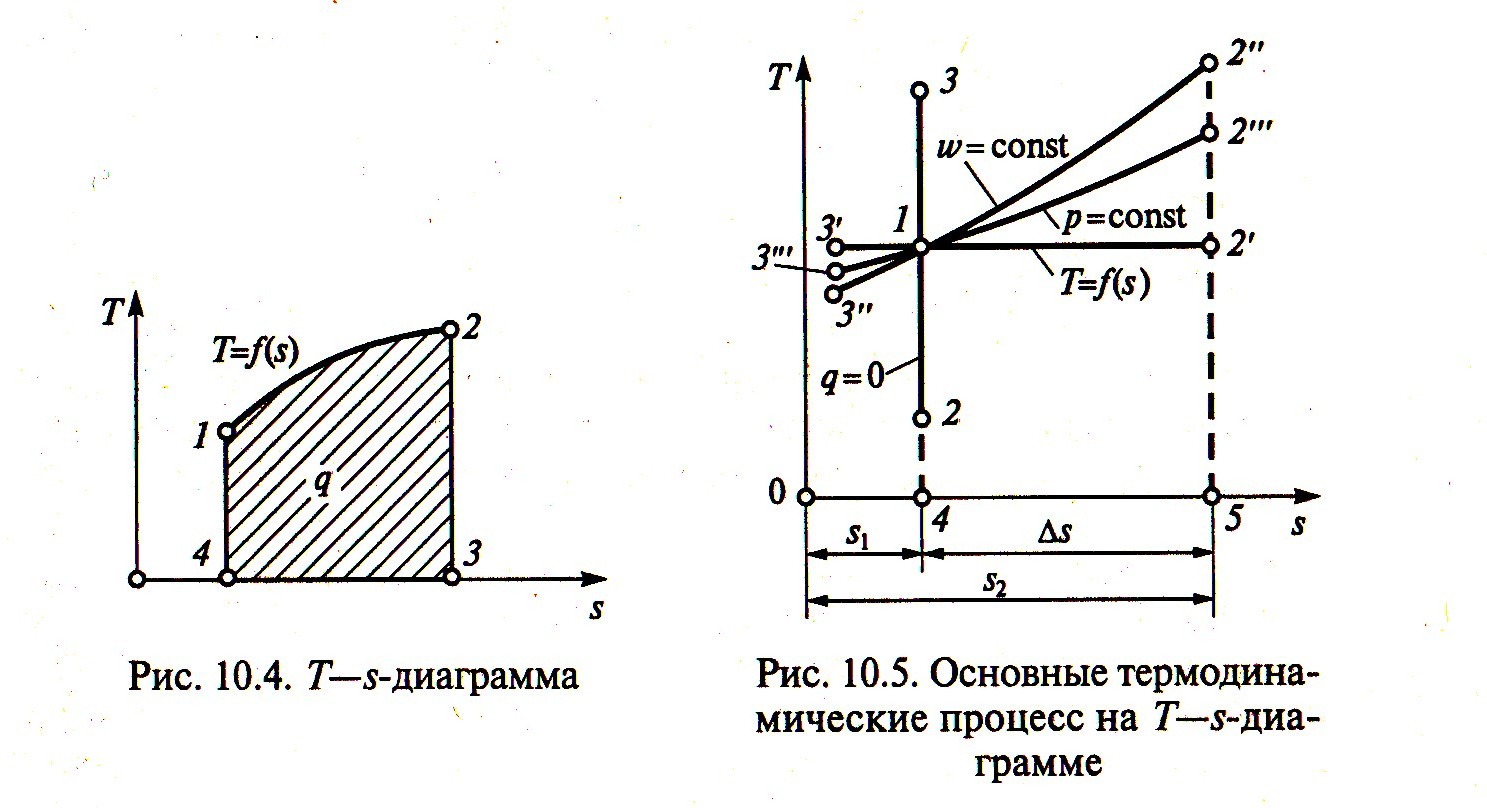
Рис. 4
![]() -диаграмма
Рис. 5 Основные
термодинамические
-диаграмма
Рис. 5 Основные
термодинамические
процессы на -диаграмме
Рассматривая
уравнения (1.12) и (1.13), можно установить,
что при
одном и том же значении
![]() энтропии
в
изобарном процессе больше, чем в
изохорном, так как
энтропии
в
изобарном процессе больше, чем в
изохорном, так как
![]() >
>
![]() .
Изобарному процессу на Т — s-диаграмме
соответствует кривая
.
Изобарному процессу на Т — s-диаграмме
соответствует кривая
![]() .
.
Изотермический
процесс на T
s-диаграмме
изображается прямой, параллельной оси
абсцисс. Отрезок
![]() соответствует
процессу расширения газа, так как при
увеличении энтропии (ds
> 0) увеличивается и удельный объем (
соответствует
процессу расширения газа, так как при
увеличении энтропии (ds
> 0) увеличивается и удельный объем (![]() >
0). Отрезок
>
0). Отрезок
![]() ’является
изображением процесса изотермического
сжатия.
’является
изображением процесса изотермического
сжатия.
Изменение энтропии газа в изотермическом процессе может быть определено из уравнений (1.9) (1.10):
![]() (1.14)
(1.14)
![]() (1.15)
(1.15)
Количество теплоты
![]() -
на Т- s
диаграмме выражается площадью
прямоугольника
-
на Т- s
диаграмме выражается площадью
прямоугольника
![]() т.е.
т.е.
![]() .
.
Тогда
![]() ,
(1.16)
,
(1.16)
Как следует из уравнения (10.15), или
![]() (1.17)
(1.17)
Для адиабатного
процесса
![]() и
и
![]() .
Следовательно,
.
Следовательно,
т.е
![]()
![]() .
.
 Таким
образом, адиабатный процесс на
Т—s-диаграмме
изображается прямой, параллельной оси
ординат. Отрезок 1—2 соответствует
процессу расширения рабочего тела (T<
0), а 1—З — процессу сжатия.
Таким
образом, адиабатный процесс на
Т—s-диаграмме
изображается прямой, параллельной оси
ординат. Отрезок 1—2 соответствует
процессу расширения рабочего тела (T<
0), а 1—З — процессу сжатия.
Циклу Карно на
Т—s-диаграмме
соответствует прямоугольник (рис 6).
Выражение для термического. КПД данного
цикла по такой диаграмме получить
проще, чем по
![]() -диагра
мме:
-диагра
мме:
![]()
Рис.6 Цикл Карно на Т-s
диаграмме
где
![]() ,
,
![]() -
площади соответствующих прямоугольников.
-
площади соответствующих прямоугольников.
Пример 1. При совершении обратимого цикла в тепловом двигателе к рабочему телу подводится 440 МДж теплоты. При этом двигатель совершает работу, равную 200 МДж. Определить термический КПД цикла.
Решение. Согласно формуле (1.2)
![]()
Пример 2. Определить КПД обратимого цикла теплового двигателя, если подвод теплоты осуществляется при температуре = 200 °С, а отвод — при температуре = 30 °С.
Решение. В соответствии с формулой (1.5)
![]()
Пример 3. Определить КПД холодильной машины, работающей по обратному циклу для температурных условий примера 2.
Решение. Согласно формуле (1.6)
![]()
Практическая работа № 5.
Тема: Понятие о круговом процессе. Цикл Карно.
Цель работы: ознакомиться с сущностью идеального цикла теплового двигателя и цикла Карно.
Ход работы:
Записать определение кругового процесса.
Объяснить сущность идеального цикла теплового двигателя.
Зарисовать прямой цикл на p-w- диаграмме, записать формулу термического КПД и дать определение прямого цикла.
Зарисовать обратный цикл на p-w- диаграмме, записать формулу холодильного коэффициента и дать определение обратного цикла.
Объяснить сущность цикла Карно (выполнить рисунок).
Записать выводы по термическому коэффициенту цикла Карно.
Вывод по работе.
Контрольные вопросы:
Каковы отличия реального и идеального циклов?
Объясните сущность цикла Карно.
Почему в реальных условиях невозможно создать двигатель, работающий по циклу Карно?
