
- •Методические указания
- •Краткие теоретические сведения. Теплоемкость. Количество теплоты.
- •Краткие теоретические сведения Понятие о термодинамических процессах
- •Внутренняя энергия и работа расширения и сжатия рабочего тела
- •Первый закон термодинамики. Энтальпия газа
- •Краткие теоретические сведения Процессы изменения состояния идеального газа.
- •Краткие теоретические сведения
- •Понятие об энтропии газа и т—s-диаграмма
- •Краткие теоретические сведения Понятие о круговом процессе
- •Цикл Карно и его термодинамическое значение
- •Краткие теоретические сведения. Циклы двигателей внутреннего сгорания.
- •Краткие теоретические сведения Уравнение состояния для реальных газов
- •Рассмотрение процесса парообразования
- •Краткие теоретические сведения. Основы теории теплообмена Виды теплообмена
- •Теплопроводность
- •Конвективный теплообмен.
- •Краткие теоретические сведения. Лучистый теплообмен.
- •Сложный теплообмен.
- •Перечень рекомендуемой литературы
Краткие теоретические сведения Процессы изменения состояния идеального газа.
Исследование термодинамических процессов проводят с целью:
установления закономерности изменения состояния рабочего тела в процессе;
выявления особенности превращения энергии в процессе.
При этом выводят уравнения процесса и устанавливают соотношение между параметрами состояния, а также определяют количество теплоты, сообщаемой рабочему телу, изменение его внутренней энергии и совершаемую работу.
Среди всего многообразия различных процессов имеются некоторые частные случаи, когда на условия протекания накладываются какие-либо ограничения. Таких случаев четыре:
процесс протекает при постоянном объеме рабочего тела (изохорный процесс);
процесс протекает при постоянном давлении рабочего тела (изобарный процесс);
процесс протекает при постоянной температуре рабочего тела (изотермический процесс);
процесс протекает без теплообмена между рабочим телом и внешней средой (изоэнтальпийный, или адиабатный процесс).
Перечисленные процессы являются частными случаями обобщающего (политропного) процесса.
Рассмотрим каждый из этих процессов.
Изохорный процесс.
Примером такого процесса может служить охлаждение или нагревание газа в герметичном сосуде. Уравнение процесса имеет вид w=const . Графическое изображение изохорного процесса в координатах р-w представляет собой отрезок прямой, параллельный оси ординат (рис.1а), который называют изохорой.
При нагревании газа его давление и температура возрастают, при охлаждении уменьшаются. Соотношение между параметрами можно найти из уравнений состояния в начале и конце процесса: p1w=RT1; p2w=RT2.
Поделив первое уравнение на второе, получим: р1/р2=Т1/Т2.
Это закон Шарля, который гласит, что в изохорном процессе давление газа изменяется прямо пропорционально его абсолютной температуре.
Так как объем газа не изменяется, то никакой работы в процессе не совершается.
Уравнение первого закона термодинамики в этом случае принимает вид dqw=du или qw=Δu.
Таким образом, в изохорном процессе вся подведенная (или отведенная) теплота идет на увеличение (или уменьшение) внутренней энергии. Δu=cwm(T2-T1).
Изображение основных термодинамических процессов
на p-w-диаграмме: а-изохорный; б-изобарный; в-изотермический; г-адиабатный

Изобарный процесс. Так называется процесс изменения состояния газа, который осуществляется при постоянном давлении. Примером может служить нагревание воздуха в помещении. Уравнение процесса р=const, а графическое изображение на р-w диаграмме – отрезок прямой, параллельный оси абсцисс, который называют изобарой (рис.1б).
Из уравнения состояния идеального газа следует:
w1/Т1 = w2/T2.
Это закон Гей-Люссака, который указывает на то, что в изобарном процессе объем газа изменяется прямо пропорционально его абсолютной температуре.
В этом процессе одна часть теплоты расходуется на изменение внутренней энергии тела, а другая часть на совершение работы.
Согласно первому закону термодинамики количество теплоты, необходимое для осуществления этого процесса, qp=Δu+Ap=cpm(T2-T1)=i2-i1.
Это означает, что теплота, сообщаемая газу в рассматриваемом процессе, идет на увеличение его энтальпии.
Изотермический процесс. Так называется процесс изменения состояния газа, который происходит при постоянной температуре. Уравнение этого процесса для идеального газа является выражением закона Бойля-Мариотта и имеет вид pw = const. Графическое изображение этого процесса на р-w-диаграмме представляет собой равнобокую гиперболу (рис.1в), которая называется изотермой. Процесс 1-2 – изотермическое расширение газа, которое возможно лишь при подводе теплоты, процесс 2-1 –изотермическое сжатие газа.
Из уравнения состояния идеального газа следует: p1/p2= w1/w2
т.е. отношение абсолютных давлений газа обратно пропорционально отношению объемов.
Т.к. температура газа в процессе не изменяется(dt=0 ), то внутренняя энергия также постоянна ( u=const ), т.е. Δu=0. Следовательно, на основании первого закона термодинамики qT=AT,
т.е. вся теплота, подведенная к газу, в изотермическом процессе расходуется на совершение механической работы.
АТ=RT ln(w2/w1); АТ=RT ln(р2/р1); АТ=р1w1 ln(w2/w1); АТ=р1w1 ln(p2/p1);
Количество подведенной теплоты в изотермическом процессе определяется по тем же формулам.
Адиабатный процесс. Адиабатными называются процессы изменения состояния рабочего тела, осуществляемые без подвода или отвода теплоты, т.е. при dq= 0. Это необходимое и достаточное условие протекания данного процесса. При этом очевидно, что q=0. Но не всякий процесс, для которого q=0, будет адиабатным, так как возможны процессы, в одной части которых теплота подводится, а в другой такое же ее количество отводится. Поэтому q=0 – условие необходимое, но не достаточное.
Примеры адиабатного процесса: расширение или сжатие газа в цилиндре, выполненном из нетеплопроводного материала; расширение или сжатие, которое протекает настолько быстро, что теплообмен с окружающей средой не успевает произойти.
Графическое изображение такого процесса в координатах p-w представляет собой кривую, называемую адиабатой (рис.1г).
В соответствии с первым законом термодинамики
Аад=u1-u2.
Работа в процессе адиабатного расширения осуществляется за счет изменения внутренней энергии рабочего тела.
Уравнение адиабатного процесса будет иметь вид:
рwk=const,
Где k-показатель адиабаты (если считать теплоемкости с и с постоянными, то для одноатомных газов k =1,67; для двухатомных k=1,4; для трех-и многоатомных k=1,3).
Найдем соотношение между параметрами T и w, а также между Т и р для адиабатного процесса.
p1/p2= (w1/w2)k; Тkp1-k=const; Тwk-1=const;
Работу, совершаемую газом в адиабатном процессе, находят по формулам
Aад=cw(T1-T2); Аад=сw(р1w1 – р2w2)/R;
Аад=(р1w1 – р2w2)/k-1; Аад=R(T1-T2)/(k-1).
Данная работа равна площади под адиабатой на p-w-диаграмме (рис.1г). Адиабата на этой диаграмме представляет собой неравнобокую гиперболу, причем более крутую, чем изотерма, поскольку k>1.
Политропный процесс. Как уже отмечалось, этот процесс является обобщающим для всего многообразия процессов изменения состояния рабочего тела. В политропном процессе происходит изменение всех параметров, тогда как в рассмотренных ранее один из параметров остается неизменным. Вид кривой, изображающей какой-либо конкретный процесс, отличается от приведенных на рис.1, а сама кривая называется политропой.
Общее уравнение политропных процессов имеет вид
рwn=const,
где n – постоянная для данного процесса величина, которая может принимать значения от 0 до ±∞ и называется показателем политропы.
Рассмотренные выше термодинамические процессы являются частными случаями политропных процессов.
При n=0 имеем р=const – изобарный процесс;
при n=1 рw=const – изотермический процесс;
если n=k, то получаем рwk=const – уравнение адиабаты;
при n= ±∞ процесс будет изохорным.
Формулы, устанавливающими связь между параметрами:
p1/p2= (w1/w2)n; Тnp1-n=const; Тwn-1=const;
Работа в политропном процессе определяется по формуле
А=(р1w1 – р2w2)/n-1.
Формула для определения теплоемкости в политропном процессе
cn=cw![]() .
.
Количество теплоты, подведенной к рабочему телу
qn=cw (Т2-Т1).
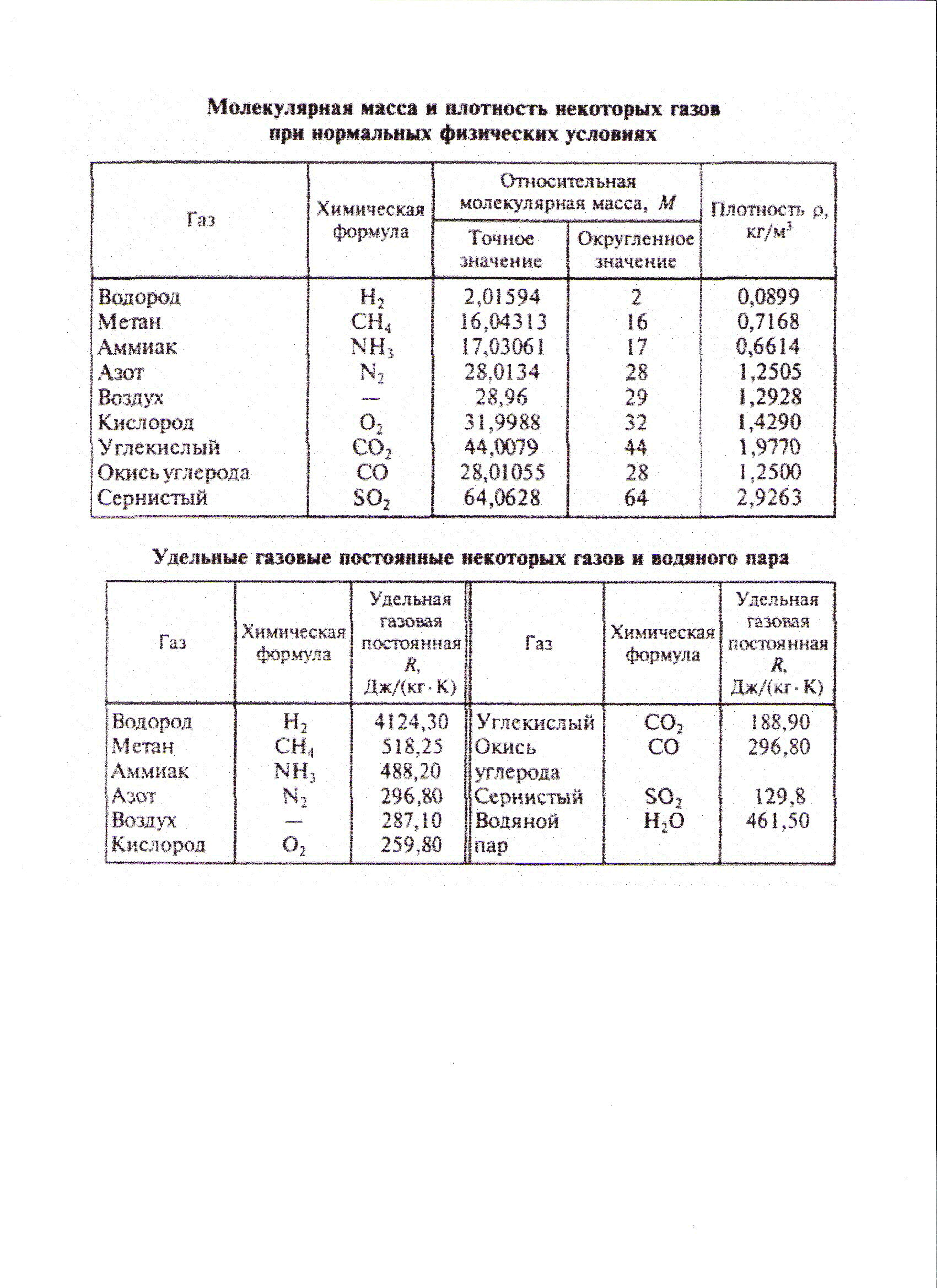
Пример 1. В баллоне объемом 15 л находится воздух под давлением 0,4 МПа и при температуре 30оС. Определить конечную температуру воздуха, если к нему подвели 16 кДж теплоты. Удельная средняя изохорная теплоемкость воздуха 736 Дж/кг·К.
Решение: Qw= Δu=mcw(T2-T1); m=p1w/(RT1).
По таблице находим, что для воздуха удельная газовая постоянная
R=287,1 Дж/кг∙К. Следовательно m=0,4∙106∙0,015:(287,1∙303)=0,069 кг.
Конечная температура воздуха
Т2=Т1= Qw/ mcw=303=16 ∙103:736 ∙0,069=303=315=618 К.
Таким образом t2=345 0C.
Пример 2. Азот массой 0,5 кг расширяется при постоянном давлении 0,3 МПа так, что его температура повышается от 100 до 300оС. Определить конечный объем азота, совершенную им работу и подведенную теплоту.
Решение: По таблице находим, что для азота удельная газовая постоянная
R=296,8 Дж/кг∙К.
Определяем начальный объем азота
W1=mRT1/p1=0,5 ∙296,8 ∙373:(0,3 ∙106)=0,184 м3.
Конечный объем
W2=W1T2/T1=0,184 ∙573:373=0,283 м3.
Работа, совершенная при расширении газа
Ap=mR(T2-T1)=0,5 ∙296,8(300-100)=29680 Дж =30 кДж.
Удельная средняя изобарная теплоемкость азота ср=1,056 кДж/кг ∙К.
Теплота, подведенная к газу
Qp=mcp(T2-T1)=0,5 ∙1,056 ∙200=105,6 кДж.
Пример 3. В компрессоре сжимается воздух массой 2 кг при постоянной температуре 2000С от начального давления р1=0,1 МПа до конечного
р2=2,5 МПа.
Определить массу воды, потребовавшуюся для охлаждения воздуха, если ее начальная температура была 15 0С, а конечная стала 50 0С. Удельная средняя теплоемкость воды св=4,19 кДж/кг ∙К.
Решение: Удельная газовая постоянная для воздуха R=287,1 Дж/кг ∙К.
Работу сжатия при изотермическом процессе находим по формуле:
АТ=RT ln(р2/р1)=2 ∙287,1 ∙473 ln(0,1/2,5)=-874 ∙103 Дж.
В изотермическом процессе Qт= Ат=-874 ∙103 Дж=-874 кДж. Знак «-» указывает на то, что теплота отводится от рабочего тела (воздух охлаждается водой).
Искомое количество воды определяем из уравнения Qт=mвcв(t 2- t 1).
mв= Qт/ (cв(t2- t 1))=874:(4,19(50-15))=5,96 кг.
Пример 4.Воздух массой 2 кг при давлении р1=1 МПа и температуре t1=300oC расширяется по адиабате так, что его объем увеличивается в 5 раз. Определить конечные объем, давление и температуру воздуха, работу расширения и изменение внутренней энергии.
Решение:
Определяем начальный объем воздуха
W1=mRT1/p1=2 ∙287,1 ∙573:(1 ∙106)=0,33 м3.
Конечный объем W2=5W1=5 ∙0,33=1,65 м3.
Конечное давление р2 определяем из уравнения p1/p2= (w1/w2)k.
Примем для воздуха значение показателя адиабаты k=1,4 (как для смеси двухатомных газов), тогда р2=р1/(W2/W1)k=1∙106:51,4=1∙106:9,52=1,05∙106Па=0,1МПа.
Конечная температура Т2=p2W2/mR=0,1∙106∙1,65:(2∙287,1)=287К, т.е. t2=140C.
Работа расширения Аад=mR(T1-T2)/(k-1)=2 ∙287,1 ∙(573-287):(1,4-1)=410553 Дж=411 кДж.
Изменение внутренней энергии U2-U1=- Аад=-411кДж.
Практическая работа № 4.
Тема: Второй закон термодинамики.
Цель работы: ознакомиться со вторым законом термодинамики понятием энтропии газа; научиться определять термический КПД.
Ход работы:
Написать формулу для определения энтропии газа и объяснить понятие энтропии.
Зарисовать Т-s диаграмму основных термодинамических процессов и записать изменение энтропии для изохорного, изобарного, изотермического и адиабатного процессов.
Зарисовать Т-s диаграмму цикла Карно и записать формулу термического КПД цикла.
При совершении обратимого цикла в тепловом двигателе к рабочему телу подводится 420 МДж теплоты. При этом двигатель совершает работу, равную 180 МДж. Определить термический КПД цикла.
Определить КПД обратимого цикла теплового двигателя, если подвод теплоты осуществляется при температуре
 °С, а отвод - при температуре
°С, а отвод - при температуре
 °С.
°С.
-
Вариант
Вариант
Вариант
1
300
30
11
220
40
21
200
30
2
200
40
12
320
30
22
300
40
3
300
30
13
240
35
23
320
35
4
320
40
14
250
30
24
220
45
5
220
35
15
200
40
25
320
30
6
320
45
16
300
35
26
220
40
7
240
30
17
320
45
27
320
35
8
250
40
18
220
30
28
240
45
9
260
35
19
320
40
29
250
30
10
340
45
20
240
35
30
260
40
Определить КПД холодильной машины, работающей по обратному циклу для температурных условий примера 5.
Вывод по работе.
Контрольные вопросы:
Назовите известные вам формулировки второго закона термодинамики.
Объясните понятие энтропии газа. Напишите формулу для ее определения.
В изохорном или изобарном процессе изменение энтропии больше и почему?
