
В механике введено понятие числа степеней свободы: это число независимых
переменных (координат), которые полностью определяют положение системы в пространстве.
Адиабатический процесс можно осуществить на установке Клемана - Дезорма (рис.1)
В большой закрытый баллон (1), соединенный с U-образным открытым водяным манометром (5) и насосом (4) нагнетается воздух. Через время t в нем установится давление P1 = H + h1 (20)
Где H – атмосферное давление, h1 – избыток давления воздуха в баллоне над атмосферным H, измеряемый манометром и равный разности уровней жидкости в манометре. Затем, если открыть кран (2), то сжатый воздух быстро выйдет наружу, т.к. кран имеет довольно большое отверстие. Как только давление в баллоне снизится и станет равным атмосферному (H) кран быстро закрывают. Такой процесс можно считать адиабатическим, т.к. он протекает быстро и потому без теплообмена.
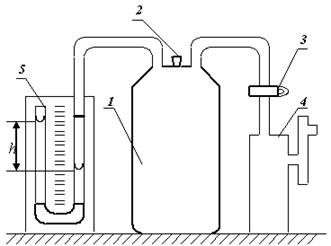
Рис.1
Пусть масса воздуха после накачивания насосом в баллоне объёмом V1 равна m.
При открывании крана часть воздуха (dm) выходит. Тогда масса оставшегося воздуха
m1, которая заключается в объеме V1, занимала перед открытием крана меньший объём V2. Таким образом, уравнение (19) для массы газа m1 в нашем случае примет вид:
HV1Y = P1V2Y , (21)
Где H и V1 – давление и объём воздуха в конце процесса; P1 и V2 - давление и объём газа в начале процесса.
При адиабатическом расширении воздух в сосуде несколько охладится, но через некоторое время вследствие теплопроводности стенок температура воздуха начнет изохорически повышаться и снова станет равной температуре окружающей среды, а давление поднимется до величины P2 = H + h2 (h2 – дополнительное давление, измеряемое манометром).
Один из основных газовых законов - закон Бойля-Мариотта согласно которому при постоянной температуре объём V данной массы идеального газа обратно пропорционален его давлению P, т. е. PV = C = const.
Закон Бойля-Мариотта следует из кинетической теории газов, если принять, что размеры молекул пренебрежимо малы по сравнению с расстоянием между ними и отсутствует межмолекулярное взаимодействие. Начальное и конечное состояние газа наблюдается при одинаковой температуре.
Поэтому на основании закона Бойля-Мариотта получим
P1 V2 = P2 V1 (22)
Решив с оответственно уравнения (21) и (22), получим
H/ P1 =( P2 / P1 )Y (23)
Логарифмируя (23), найдем
lgH – lgP1 = γ * (lgP2 - lg P1),
откуда
γ = (lgP1 - lgH ) / ( lgP1 – lgP2 ) (24)
Поскольку на практике давления H, P1 и P2 незначительно отличаются друг от друга , то разности логарифмов можно заменить разностями самих величин:
γ = (P1 – H) / (P1 - P2 ) (25)
Если учесть, что P1 = H + h1, а P2 = H + h2 , из уравнения (25) получим расчетную формулу для данного опыта:
γ = h1 / h1 – h2 (26)
