
РГПУ им. А. И. Герцена
К работе допущены
Работа выполнена
Отчет сдан
Отчет по лабораторной работе № 2
«Определение отношения теплоемкостей воздуха
методом Клемана – Дезорма»
Работу выполнила: Леонтьева
Василиса
Романовна
Факультет Технологии и предпринимательства
Группа 3
Цель работы: Опытное определение отношения теплоемкости воздуха при постоянном давлении Ср к теплоемкости при постоянном объеме Сv методом адиабатического расширения.
Принадлежности: прибор Клемана – Дезорма, манометр, секундомер, ручной насос.
Для выполнения работы необходимо знать:
- Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
- Состояние идеального газа характеризуют три макроскопические величины: P — давление, V — объем, Т — температура.
На основе модели идеального газа были теоретически выведены ранее установленные
опытным путем экспериментальные законы (закон Бойля— Мариотта, закон Гей- Люссака, закон Шарля, закон Авогадро. Эта модель легла в основу молекулярно-кинетических представлений.
Уравнение состояния идеального газа (уравнение Клапейрона или Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
где
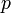 —
давление,
—
давление,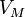 —
молярный
объём,
—
молярный
объём,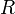 —
универсальная
газовая постоянная
—
универсальная
газовая постоянная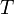 —
абсолютная
температура, К.
—
абсолютная
температура, К.
Так
как
![]() ,
где
,
где
![]() —
количество
вещества, а
—
количество
вещества, а
![]() ,
где
,
где
![]() —
масса,
—
масса,
![]() —
молярная
масса, уравнение
состояния можно записать:
—
молярная
масса, уравнение
состояния можно записать:
![]()
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
![]()
![]()
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
![]() —
закон
Бойля — Мариотта.
—
закон
Бойля — Мариотта.
![]() —
Закон
Гей-Люссака.
—
Закон
Гей-Люссака.
![]() —
закон
Шарля
—
закон
Шарля
А
в форме пропорции
![]() этот
закон удобен для расчёта перевода газа
из одного состояния в другое.
этот
закон удобен для расчёта перевода газа
из одного состояния в другое.
Количество теплоты, необходимое для нагревания тела на один градус, называется теплоемкостью вещества тела., теплоемкость одного моля вещества — молярной теплоемкостью.
Уде́льная теплоёмкость (Удельная теплота нагревания на один градус, обозначается как c) вещества определяется как количество тепловой энергии, необходимой для повышения температуры одного килограмма вещества на один градус.
с=1/m*dQ/dT (1)
Формула (1) представлена в дифференцированной форме потому, что удельная теплоемкость реальных тел и газов зависит от температуры. Поскольку количество теплоты зависит от процесса, то и теплоемкость существенно зависит от процесса.
Теплоемкость одного моля вещества называется молярной теплоемкостью.
C=м/m*dQ/dT (2) ; с=С/ м (3) Где м – молярная масса .
Единицей СИ для удельной теплоёмкости является джоуль на килограмм-кельвин. Следовательно, удельную теплоёмкость можно рассматривать как теплоёмкость единицы массы вещества. На значение удельной теплоёмкости влияет температура вещества.
