
- •Розміри геномів та кількість білкових генів деяких організмів
- •Молекулярна організація хроматину
- •Нуклеосома
- •Посттрансляційні модифікації гістонових хвостів
- •Гістон н1
- •Наднуклеосомна упаковка хроматинової фібрили
- •Петлеві домени хроматину та ядерний матрикс
- •Контрольні запитання
- •Рекомендована література
Посттрансляційні модифікації гістонових хвостів
Невпорядковані хвости корових гістонів є субстратом для ковалентних посттрансляційних модифікацій, яким піддаються конкретні (такі, що мають конкретну позицію в складі поліпептидного ланцюга) амінокислотні залишки певного типу.
Основні типи цих модифікацій (рис. 4.12):
Ацетилювання залишків Lys – перенос залишку оцтової кислоти (ацетату) на аміногрупу Lys. Реакція каталізується гістон-ацетилтрансферазами (HAT, Histone AcetylTransferase), різні їх типи мають певну специфічність щодо залишків-мішеней. Результатом реакції є зникнення позитивного заряду на залишку Lys (рис. 4.12). Ацетилювання є динамічною модифікацією: гістон-деацетилази (HD, Histone Deacetylase, позначаються також як HDAC) здійснюють відщеплення ацетатних залишків. Два типи ферментів-антагоністів підтримують певний динамічний гомеостаз ацетилювання/деацетилювання, зсунутий в той чи інший бік у певних ділянках хроматину.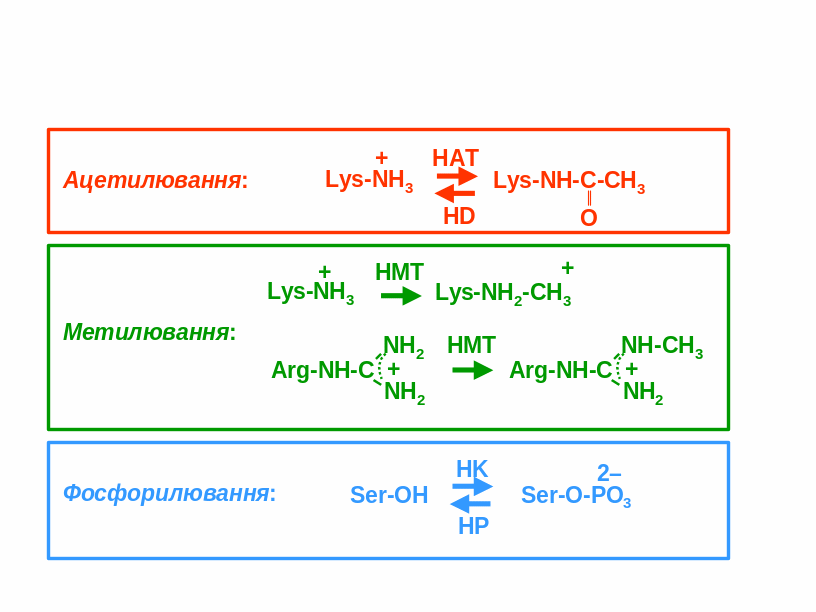 Рис.
4.12. Посттрансляційні
модифікації амінокислотних залишків
у гістонах (показано лише хімічні групи
в складі залишків, які безпосередньо
модифікуються). HAT
– гістон-ацетилтрансфераза, HD
– гістон-деацетилаза, HMT
– гістон-метилтрансфераза, HK
– гістон-кіназа, НР – гістон-фосфатаза.
Рис.
4.12. Посттрансляційні
модифікації амінокислотних залишків
у гістонах (показано лише хімічні групи
в складі залишків, які безпосередньо
модифікуються). HAT
– гістон-ацетилтрансфераза, HD
– гістон-деацетилаза, HMT
– гістон-метилтрансфераза, HK
– гістон-кіназа, НР – гістон-фосфатаза.Метилювання залишків Lys та Arg – перенос метильної групи (однієї чи двох) на аміногрупу Lys або на гуанідинову групу Arg, позитивний заряд при цьому залишається. Реакція каталізується гістон-метилтрансферазами (HMT, Histone MethylTransferase), кожна з яких є специфічною щодо залишку-мішені. На відміну від ацетилювання, метилювання є дуже стабільною у часі модифікацією. Метильовані гістони замінюються на неметильовані дуже повільно – імовірно, лише шляхом заміни на гістони, синтезовані de novo.
Фосфорилювання залишків Ser – перенос фосфатного залишку на ОН-групу Ser. Реакція каталізується гістон-кіназою (HK, Histone Kinase), відщеплення фосфату – фосфатазою.
Конкретні залишки, що модифікуються показані на рис. 4.13. Серед усіх модифікацій, лише про ацетилювання можна сказати, що воно чітко корелює з транскрипційною активністю: гіперацетильовані гістони присутні у активних ділянках хроматину, у репресованих підтримується деацетильований статус. Інші модифікації впливають на функціональний стан складніше: метилювання одного залишку може викликати репресію транскрипції, іншого (через кілька амінокислот від першого в тому самому хвості) – супроводжувати активацію; фосфорилювання H3-Ser10 корелює з активацією транскрипції, але також супроводжує гіперконденсацію хроматину при переході до мітозу.
Оскільки
ацетилювання численних залишків Lys
(рис. 4.13) призводить до суттєвого пониження
позитивного заряду хвостів, лише
ацетилювання може безпосередньо впливати
на взаємодію хвостів з ДНК. Це не
призводить до змін структури
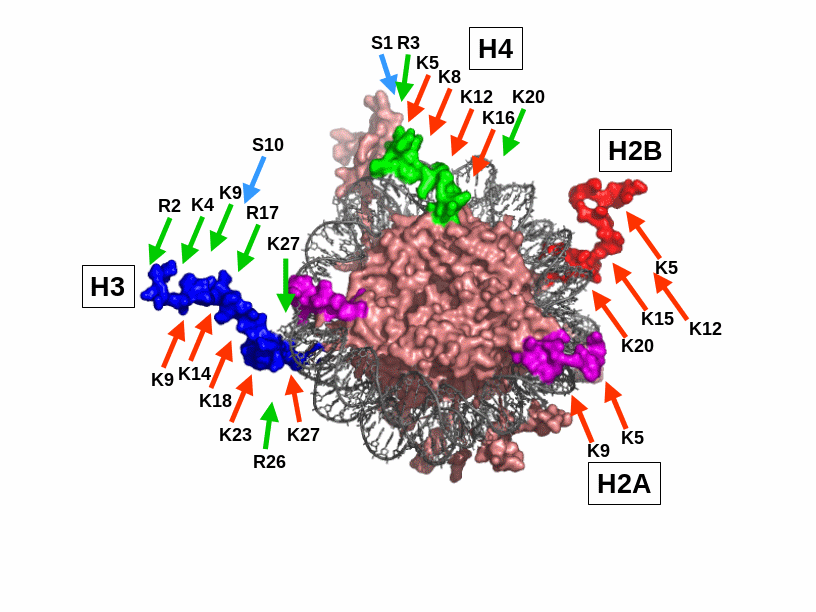 Рис.
4.13. Кінцеві хвости
гістонів у структурі нуклеосоми (1KX5)
та їх модифікації. Кольором виділено
по одному N-кінцевому
хвосту кожного гістона, а також С-кінцевий
– гістона Н2А (поряд із N-кінцем
Н3). Стрілочкамі вказано ацетилювання
(червоні), метилювання (зелені) та
фосфорилювання (блакитні) залишків
певного типу, які займають певні позиції
у поліпептидних ланцюгах.
Рис.
4.13. Кінцеві хвости
гістонів у структурі нуклеосоми (1KX5)
та їх модифікації. Кольором виділено
по одному N-кінцевому
хвосту кожного гістона, а також С-кінцевий
– гістона Н2А (поряд із N-кінцем
Н3). Стрілочкамі вказано ацетилювання
(червоні), метилювання (зелені) та
фосфорилювання (блакитні) залишків
певного типу, які займають певні позиції
у поліпептидних ланцюгах.
Проте, головним механізмом впливу модифікованих гістонових хвостів на функціональний стан хроматину є специфічне впізнання модифікованих хвостів іншими білками: регуляторами, факторами транскрипції, ферментами тощо. Так, ацетильовані залишки Lys впізнаються особливим структурним блоком таких білків – бромодоменом. Інший блок – хромодомен – впізнає метильовані Lys. Гістонові хвости використовуються як своєрідні платформи для збірки різноманітних білкових комплексів, і характер цієї збірки залежить від патерну модифікацій – розподілу певних модифікованих груп по хвостах. Співвідношення між патерном модифікацій та набором білків, який впізнає такий патерн, що, у свою чергу, має певні функціональні наслідки, називають гістоновим кодом.
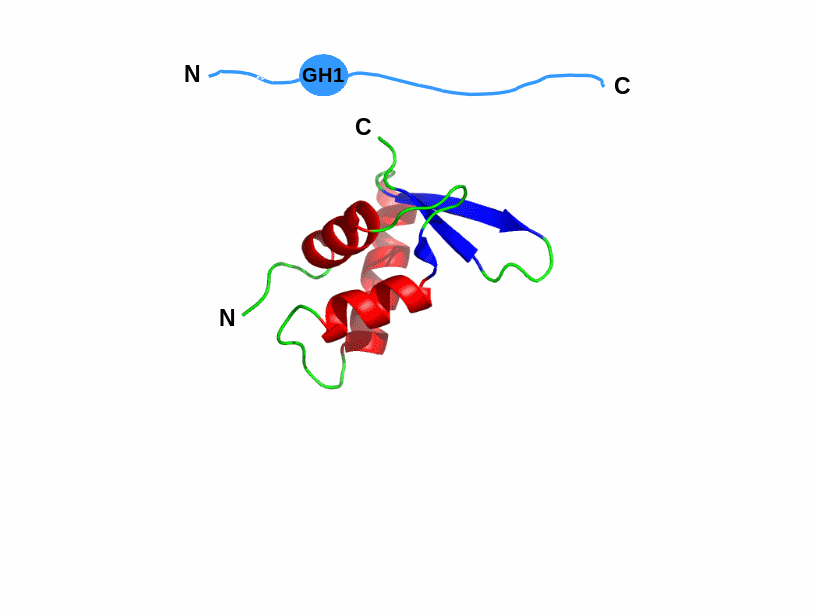 Рис.
4.14. Схема будови гістона
Н1 та структура його глобулярного домену
GH1 (1HST).
Рис.
4.14. Схема будови гістона
Н1 та структура його глобулярного домену
GH1 (1HST).
