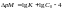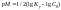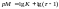- •1 Вопрос. Предмет аналитической химии. Значение аналитической химии в развитии естествознания, техники, экономики.
- •2 Вопрос. Химический анализ. Виды объектов анализа.
- •3 Вопрос. Методы аналитической химии. Гибридные методы. Понятие методики анализа.
- •4 Вопрос. Виды анализа: элементный, функциональный, молекулярный, вещественный, фазовый.
- •5 Вопрос. Классификация аналитических методов. Химические, физические и биологические методы анализа.
- •6 Вопрос. Требования, предъявляемые к методам анализа
- •7 Вопрос. Макро-, микро- и ультрамикроанализ.
- •8 Вопрос. Обеспечение химического анализа: химические реактивы, классификация, общая характеристика, степень чистоты, очистка.
- •9 Вопрос. Основные аналитические характеристики: чувствительность и избирательность определений.
- •10 Вопрос. Основные стадии химического анализа.
- •11 Вопрос. Выбор метода анализа и составление схем анализа. Абсолютные (безэталонные) и относительные методы анализа.
- •13 Вопрос. Основные характеристики метода анализа: правильность и воспроизводимость, коэффициент чувствительности, предел обнаружения, нижняя граница определяемых содержаний.
- •14 Вопрос. Способы оценки правильности аналитических определений: использование стандартных образцов, метод добавок.
- •15 Вопрос. Задачи и выбор метода обнаружения и идентификации химических соединений. Аналитические сигналы в хма.
- •16 Вопрос. Классификация аналитических реакций и реагентов.
- •17 Вопрос. Дробный и систематический ход качественного анализа.
- •18 Вопрос. Кислотно-основная классификация катионов. Групповые реагенты на катионы и предъявляемые к ним требования.
- •19 Вопрос. Бариево-серебряная классификация анионов. Групповые реагенты на анионы и предъявляемые к ним требования.
- •20 Вопрос. Схема анализа неизвестной неорганической соли.
- •22 Вопрос. Равновесие в системе раствор - осадок. Константа растворимости и ее значение.
- •23 Вопрос. Факторы, влияющие на растворимость осадков. Условия выпадения осадка.
- •24 Вопрос. Способы выражения концентраций растворов в титриметрии. Эквивалент, молярная масса эквивалента, способы выражения долей.
- •25 Вопрос. Методы титриметрического анализа. Требования, предъявляемые к реакции в титриметрическом анализе.
- •26 Вопрос. Виды титриметрических определений. Приемы титрования.
- •27 Вопрос. Стандартизация растворов. Первичные и вторичные стандарты.
- •28 Вопрос. Кислотно-основные реакции. Современные представления о кислотах и основаниях. Теория Бренстеда-Лоури.
- •29 Вопрос. Равновесие в системе кислота - сопряженное основание и растворитель. Константы кислотности и основности. Константа автопротолиза.
- •30 Вопрос. Кислотно-основное равновесие в многокомпонентных системах. Вычисления рН растворов кислот и оснований.
- •31 Вопрос. Буферные растворы и их своиства. Буферная емкость.
- •32 Вопрос. Способы обнаружения точки эквивалентности. Кислотно-основные индикаторы. Индикаторные ошибки.
- •33 Вопрос. Кислотно-основное титрование. Методология построения кривых титрования.
- •35 Вопрос. Титрование многопротонных кислот.
- •36 Вопрос. Окислительно-восстановительные реакции. Стандартные электродные потенциалы и их определение.
- •37 Вопрос. Факторы, влияющие на величину реального редокс потенциала. Уравнение Нернста.
- •38 Вопрос. Условия протекания окислительно-восстановительных реакций.
- •39 Вопрос. Особенности механизма окислительно-восстановительных реакций.
- •40 Вопрос. Окислительно-восстановительные индикаторы
- •41 Вопрос. Окислительно-восстановительное титрование. Методология построения кривых титрования.
- •42 Вопрос. Иодометрия. Система иод-иодид как окислитель или восстановитель.
- •43 Вопрос. Перманганатометрия. Возможности метода.
- •45 Вопрос. Комплексометрическое титрование. Использование аминополикарбоновых кислот в комплексонометрии.
- •47 Вопрос. Металлохромные индикаторы и требования, предъявляемые к ним.
- •48 Вопрос. Возможности комплексонометрического титрования. Примеры определений.
43 Вопрос. Перманганатометрия. Возможности метода.
Перманганатометрия – один из наиболее часто применяемых методов окислительно-восстановительного титрования. В качестве титранта используют раствор перманганата калия, окислительные свойства которого можно регулировать в зависимости от кислотности раствора.
![]()
К достоинствам перманганатометрического метода относят:
1) возможность титрования раствором КМnО4 в любой среде (кислой, нейтральной, щелочной);
2) применимость растворов перманганата калия в кислой среде для определения многих веществ, которые не взаимодействуют с более слабыми окислителями; 3) стехиометричность и достаточно высокую скорость большинства окислительно-восстановительных реакций с участием МnО4- при оптимально выбранных условиях ;
4) возможность титрования без индикатора;
5) доступность перманганата калия.
Перманганатометрию используют в следующих целях :
1. Определение восстановителей
2. Определение окислителей.
3. Определение веществ, не обладающих окислительно-восстановительными свойствами (титрование по замещению). Например, ионы кальция, цинка, кадмия, кобальта осаждают в виде малорастворимых оксалатов.
4. Определение органических соединений (при обратном титровании).
44 вопрос. Реакции комплексообразования, используемые в аналитической химии. Количественные характеристики комплексных соединений: константы устойчивости и нестойкости.
Химические реакции, используемые в методах титриметрического анализа, в том числе в методах, основанных на комплексообразовании, должны удовлетворять определенным требованиям:
1) реакция должна быть стехиометричной;
2) реакция должна сопровождаться достаточно большим уменьшением энергии Гиббса и, следовательно, достаточно большой константой равновесия;
3) реакция должна протекать достаточно быстро. Кроме того, необходим удобный способ определения точки эквивалентности.
Для количественной характеристики устойчивости внутренней сферы комплексного соединения используют константу равновесия, описывающую полную ее диссоциацию, называемую константой нестойкости комплекса Kнест. Чем меньше Кнест, тем стабильнее внутренняя сфера комплекса, т. е. тем меньше она диссоциирует в водном растворе.
Константа равновесия реакции - константа устойчивости комплексного соединения:
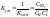
Лиганды:
-ОН – гидроксильная группа, -SH – сульфгидрильная (меркапто-) группа,
-СООН – карбоксильная группа
-NH2- аминогруппа, =N-OH – оксимная группа, О=С< – карбонильная группа.
45 Вопрос. Комплексометрическое титрование. Использование аминополикарбоновых кислот в комплексонометрии.
Комплексометрическое титрование – метод титриметрического анализа, основанный на исполь-
зовании реакций комплексообразования между определяемым компонентом анализируемого раствора и титрантом. Метод применяют для определения катионов металлов - комплексообразователей.
При комплексометрическом титровании в качестве титрантов используют вещества, способные образовывать прочные комплексы с анализируемым веществом.
Комплексон I – это трехосновная нитрилотриуксусная кислота (НТА):
Н![]() аибольшее
распространение в аналитической
практике получила этилендиаминтетрауксусная
кислота – ЭДТА – (НООС
- СН2)2 –
N- CH2 –
CH2 –
N – (CH2COOH)2 и
ее натриевая соль - трилон
Б.
аибольшее
распространение в аналитической
практике получила этилендиаминтетрауксусная
кислота – ЭДТА – (НООС
- СН2)2 –
N- CH2 –
CH2 –
N – (CH2COOH)2 и
ее натриевая соль - трилон
Б.
![]()
![]()
Этот титрант применяется, прежде всего, для количественного определения катионов металлов (Fe3+, Cr3+, Ca2+, Mg2+ и др.). Молекула ЭДТА реагирует всегда с 1 катионом металлом, т.е. фактор эквивалентности равен 1. 46 вопрос. Методология построения кривых комплексонометрического титрования.
τ<1 |
|
τ=1 |
|
τ>1 |
|
Скачок
титрования: