
- •1 Вопрос. Предмет аналитической химии. Значение аналитической химии в развитии естествознания, техники, экономики.
- •2 Вопрос. Химический анализ. Виды объектов анализа.
- •3 Вопрос. Методы аналитической химии. Гибридные методы. Понятие методики анализа.
- •4 Вопрос. Виды анализа: элементный, функциональный, молекулярный, вещественный, фазовый.
- •5 Вопрос. Классификация аналитических методов. Химические, физические и биологические методы анализа.
- •6 Вопрос. Требования, предъявляемые к методам анализа
- •7 Вопрос. Макро-, микро- и ультрамикроанализ.
- •8 Вопрос. Обеспечение химического анализа: химические реактивы, классификация, общая характеристика, степень чистоты, очистка.
- •9 Вопрос. Основные аналитические характеристики: чувствительность и избирательность определений.
- •10 Вопрос. Основные стадии химического анализа.
- •11 Вопрос. Выбор метода анализа и составление схем анализа. Абсолютные (безэталонные) и относительные методы анализа.
- •13 Вопрос. Основные характеристики метода анализа: правильность и воспроизводимость, коэффициент чувствительности, предел обнаружения, нижняя граница определяемых содержаний.
- •14 Вопрос. Способы оценки правильности аналитических определений: использование стандартных образцов, метод добавок.
- •15 Вопрос. Задачи и выбор метода обнаружения и идентификации химических соединений. Аналитические сигналы в хма.
- •16 Вопрос. Классификация аналитических реакций и реагентов.
- •17 Вопрос. Дробный и систематический ход качественного анализа.
- •18 Вопрос. Кислотно-основная классификация катионов. Групповые реагенты на катионы и предъявляемые к ним требования.
- •19 Вопрос. Бариево-серебряная классификация анионов. Групповые реагенты на анионы и предъявляемые к ним требования.
- •20 Вопрос. Схема анализа неизвестной неорганической соли.
- •22 Вопрос. Равновесие в системе раствор - осадок. Константа растворимости и ее значение.
- •23 Вопрос. Факторы, влияющие на растворимость осадков. Условия выпадения осадка.
- •24 Вопрос. Способы выражения концентраций растворов в титриметрии. Эквивалент, молярная масса эквивалента, способы выражения долей.
- •25 Вопрос. Методы титриметрического анализа. Требования, предъявляемые к реакции в титриметрическом анализе.
- •26 Вопрос. Виды титриметрических определений. Приемы титрования.
- •27 Вопрос. Стандартизация растворов. Первичные и вторичные стандарты.
- •28 Вопрос. Кислотно-основные реакции. Современные представления о кислотах и основаниях. Теория Бренстеда-Лоури.
- •29 Вопрос. Равновесие в системе кислота - сопряженное основание и растворитель. Константы кислотности и основности. Константа автопротолиза.
- •30 Вопрос. Кислотно-основное равновесие в многокомпонентных системах. Вычисления рН растворов кислот и оснований.
- •31 Вопрос. Буферные растворы и их своиства. Буферная емкость.
- •32 Вопрос. Способы обнаружения точки эквивалентности. Кислотно-основные индикаторы. Индикаторные ошибки.
- •33 Вопрос. Кислотно-основное титрование. Методология построения кривых титрования.
- •35 Вопрос. Титрование многопротонных кислот.
- •36 Вопрос. Окислительно-восстановительные реакции. Стандартные электродные потенциалы и их определение.
- •37 Вопрос. Факторы, влияющие на величину реального редокс потенциала. Уравнение Нернста.
- •38 Вопрос. Условия протекания окислительно-восстановительных реакций.
- •39 Вопрос. Особенности механизма окислительно-восстановительных реакций.
- •40 Вопрос. Окислительно-восстановительные индикаторы
- •41 Вопрос. Окислительно-восстановительное титрование. Методология построения кривых титрования.
- •42 Вопрос. Иодометрия. Система иод-иодид как окислитель или восстановитель.
- •43 Вопрос. Перманганатометрия. Возможности метода.
- •45 Вопрос. Комплексометрическое титрование. Использование аминополикарбоновых кислот в комплексонометрии.
- •47 Вопрос. Металлохромные индикаторы и требования, предъявляемые к ним.
- •48 Вопрос. Возможности комплексонометрического титрования. Примеры определений.
40 Вопрос. Окислительно-восстановительные индикаторы
Редокс- или окислительно-восстановительные индикаторы изменяют цвет в зависимости от присутствия в растворе окислителей или восстановителей. Дифениламин бесцветен в восстановленной форме, но имеет фиолетовый цвет в окисленном состоянии. Некоторые ярко окрашенные вещества сами могут служить индикатором. Например, при перманганатометрическом определении железа(II)
10FeSO4 + 2KMnO4+ 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
добавляемый в процессе титрования раствор перманганата обесцвечивается, пока не будут окислены все ионы Fe2+, имевшиеся в исследуемом растворе. Точка эквивалентности определяется по розовой окраске раствора, из-за возникшего избытка перманганат-анионов.
Хингидрон также является окислительно-восстановительным индикатором. это смесь хинона и гидрохинона..
2,2 - Дипиридил (комплекс с рутением) в разб HNO3: Цвет окисл формы не имеет, Цвет восст.формы - желтый.
Нитро-о-фенантролин (нитроферроин), комплекс с Fe2. Цвет окисл.формы бледноголубой, Цв. Восст. Красный
Вариаминовый синий 0,5% р-р HCl соли: Цвет окисл формы фиолетовый Цв. Восст. Не имеет.
41 Вопрос. Окислительно-восстановительное титрование. Методология построения кривых титрования.
Методы окислительно-восстановительного (ОВ) титрования или red-ox-методы – это титриметрические методы, основанные на использовании окислительно-восстановительных реакций.
О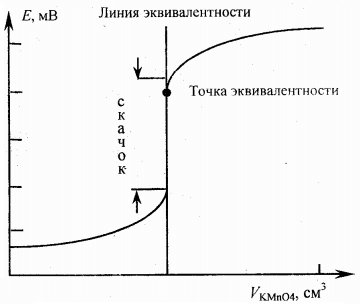 бычно
их классифицируют следующим образом.
бычно
их классифицируют следующим образом.
1 По характеру титранта:
– оксидиметрические – методы определения восстановителей с применением титранта-
окислителя;
– редуктометрические – методы определения окислителя с применением титранта-восстановителя.
2 По природе реагента (титранта), взаимодействующего с определенным веществом:
– KMnO4 – перманганатометрия;
– KBrO3 – броматометрия;
– KI, Na2S2O3 – иодометрия;
– I2 – иодиметрия;
– Br2 – бромометрия;
– Ce(SO4)2 – цериметрия.
Требования к ОВР:
- реакция должна протекать практически до конца;
- ОВР идет тем полнее, чем больше константа равновесия. При значении K>>10^8 реакция протекает не менее, чем на 99,99%;
- реакция должна протекать стехиометрически, побочные процессы должны быть исключены;
- конечная точка титрования должна определяться точно и однозначно, либо с индикаторами, либо без них.
В ОВ титровании применяется прямое, обратное и заместительное титрование.
Процесс окислительно-восстановительного титрования можно изобразить графически как измене-
ние окислительно-восстановительного потенциала Е раствора в процессе титрования.
Для
реакции![]() рассчитаем потенциал Е:
рассчитаем потенциал Е:
![]()
На основании этих данных строят кривую титрования (рис.1)
42 Вопрос. Иодометрия. Система иод-иодид как окислитель или восстановитель.
Иодометрия
В основе метода реакция:
2I- + Ox → I2+ Red
I2 , выделяющийся в количестве, эквивалентном количеству вступившего в ре-
акцию окислителя, оттитровывают стандартным раствором тиосульфата натрия.
I2 + 2S2O32-→ 2I- + S4O62-.
Титрант – стандартный раствор Na2S2O3 (0,1 н; 0,05 н; 0,02 н). Готовить по точной навеске нельзя, так как при хранении Na2S2O3⋅5H2O обезвоживается.
Восстановители определяют прямым титрованием р-ром I2 в присут. избытка KI (этот метод часто наз. иодиметрией), окислители - косвенным методом по кол-ву иода, образовавшегося при их взаимод. с KI. Прямая иодометрия применяется для определения As (III), Sn(II), Sb(III), сульфидов, сульфитов, тиосульфатов и др., косвенная - для определения Сu (II), О2, Н2О2, Вr2, броматов и др. В качестве индикаторов используют обычно крахмал.
