
- •Неорганическая химия. Химия элементов
- •Глава 11
- •11.1. Общая характеристика
- •11.1.1. Положение в Периодической системе
- •11.1.2. Строение электронной оболочки, валентность, основные типы химических соединений
- •11.1.3. Нахождение в природе, изотопный состав
- •11.1.4. Краткие исторические сведения
- •11.2. Простые вещества
- •11.3. Сложные соединения элементов 11-й группы
- •11.3.1. Кислородные соединения
- •11.3.1.1. Оксиды и гидроксиды
- •11.3.1.2. Соли кислородосодержащих кислот, основные соли.
- •11.3.2. Галогениды
- •11.3.2.4. Высшие степени окисления
- •11.3.3. Другие бинарные соединения
- •11.3.3.1. Халькогениды
- •11. 3.3.2. Нитриды и фосфиды
- •11.3.3.3. Карбиды
- •11.3.3.4. Гидриды
- •11.4. Комплексные и металлоорганические соединения элементов 11-й группы
- •11.4.1. Комплексные соединения эi
- •11.4.2. Комплексные соединения эii
- •11.4.3. Комплексные соединения эiii
- •11.4.4. Комплексные соединения эiv и эv
- •11.4.5. Металлоорганические соединения
- •11.5. Технологические процессы в химии элементов 11-й группы
- •11.5.1. Получение меди
- •11.5.2.Получение серебра
- •11.5.3 Получение золота
- •11.5.4. Основные процессы серебряной фотографии
- •11.6. Биологическая роль элементов 11-й группы
Ю.Д. Третьяков, Л.И. Мартыненко, А.Н. Григорьев, А.Ю. Цивадзе
Неорганическая химия. Химия элементов
Учебник для вузов: В 2 книгах. Книга II/. – М.: Химия, 2001.
Глава 11
11-Я ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ - ГРУППА МЕДИ
11.1. Общая характеристика
11.1.1. Положение в Периодической системе
В 11-ю группу ПС входят медь 29Сu, серебро 47Ag и золото 79Аu. Их важнейшие характеристики представлены в табл. 11.1. Так как валентные электроны расположены на (n - 1)d- и ns-подуровнях, элементы 11-й группы относятся к числу переходных. Из табл. 11.1 видно, что радиус нейтральных атомов растет при переходе от Сu к Ag, а. затем остается неизменным. Размер ионов увеличивается от Сu к Аg, но наибольший рост наблюдается между Сu и Ag. В близости радиусов серебра и золота проявляется, как и в рассмотренных ранее группах, влияние лантанидного сжатия. Поскольку свойства простых и сложных соединений 4d- и 5d-элементов 11-й группы различаются сильнее, чем в 4-й и 5-й группах, проблемы разделения их смесей, выделенных из природных соединений, не возникает.
11.1.2. Строение электронной оболочки, валентность, основные типы химических соединений
Как видно из табл. 11.1, особенностью элементов 11-й группы является завершенность у изолированных атомов Э0 электронного d-подуровня с главным квантовым числом, равным номеру предыдущего периода (3d10 у меди, 4d10 у серебра и 5d10 у золота), кoторая достигается за счет «перескока» на (n - 1) d-подуровень одного из двух электронов ns-подуровня, заполненного еще у элементов 2-й группы ПС. Аналогичное перераспределение наблюдается и у других переходных элементов, например, в группе хрома и у платиновых элементов, т. е. в тех случаях, когда близок к завершению наполовину (d5) или полностью (d10) заполненный электронами (n - 1) d-подуровень.
Завершенность «предвнешнего» электронного подуровня обусловливает химическую инертность простых веществ - металлов, образованных элементами 11-й группы. Действительно, из-за присутствия в атомах Сu, Ag и Аu «замкнутой» d10-электронной оболочки эти элементы обладают, в соответствии с правилами Фаянса, большим поляризующим действием - притягивают внешние электроны и склонны их сохранять при себе.
У элементов 11-й группы ПИ1 существенно выше, чем в 1-й группе (см. табл. 1.1), также имеющих на внешней электронной оболочке один s-электрон. Это можно объяснить жесткостью 8-электронного предвнешнего слоя, предшествующего у ЩЭ валентным электронам, и отсутствием у них дополнительного эффекта поляризации из-за малой деформируемости электронных оболочек атомов.
Другое объяснение предполагает проникновение ns-электрона атомов элементов 11-й группы под экран (n - 1)d10-электронов, что приводит к повышению ПИ1 у элементов рассматриваемой группы по сравнению с ПИ1 у ЩЭ, которые такого экрана d-электронов не имеют. Увеличение ПИ1 при переходе от Ag к Аu обусловлено, с этой точки зрения, проникновением 6s-электрона под экран не только 5d10-электронов, но и 4f14-электронов.
Что касается значений ПИ2, то у всех трех элементов, составляющих 11-ю группу, они почти одинаковы и заметно меньше, чем у ЩЭ. Таким образом, разница в электронном строении является главной причиной резко контрастирующих свойств элементов 1-й (самые активные металлы) и 11-й (гораздо менее активные металлы) групп ПС.
Таблица 11.1. Важнейшие характеристики элементов 11-й группы
Элемент |
Ar |
Электронная конфигурация изолированного атома* |
Радиус, Å |
Потенциал ионизации, эВ |
ЭО |
Степень окисления |
|||||
Э0 |
Э+ |
Э2+ |
Э3+ |
ПИ1 |
ПИ2 |
ПИ3 |
|||||
29Cu |
63,546 |
3s23p63d104s1 |
1,28 |
0,46 (КЧ=2), 0,60 (КЧ=4), 0,77 (КЧ=6) |
0,57 (КЧ=4), 0,73 (КЧ=6) |
0,54 (КЧ=6) |
7,73 |
20,29 |
36,83 |
1,75 |
0, +1, +2, (+3), (+4) |
47Ag |
107,8682 |
4s24p64d105s1 |
1,44 |
0,67 (КЧ=2), 1,00 (КЧ=4), 1,15 (КЧ=6) |
0,79 (КЧ=4) 0,94 (КЧ=6) |
0,67 (КЧ=4), 0,75 (КЧ=6) |
7,58 |
21,49 |
34,83 |
1,42 |
0, +1, (+2) (+3), (+5) |
79Аu |
196,96654 |
4s24p64d104f145s25p65d106s1 |
1,44 |
1,37 (КЧ=6) |
|
0,68 (КЧ=4) 0,85 (КЧ=6) |
9,22 |
20,52 |
30,47 |
1,42 |
0, +1, +3, (+5), (+7) |
*Здесь и далее в книге для краткости указана конфигурация внешних и предвнешних электронных оболочек изолированного атома, полное распределение электронов, например, для рубидия выглядит как 1s22s22p63s23p63d104s24p65s1 (в сокращенном виде [Kr]5s1).
**В скобках даны менее характерные степени окисления
Особенность электронной структуры атомов элементов 11-й группы (подвижность электронной оболочки) обусловливает относительную большую устойчивость двухатомных молекул Cu2, Ag2, Au2 (энергии диссоциации 174, 157, 210 кДж/моль соответственно) по сравнению с молекулами К2, Rb2 и Cs2 (энергии диссоциации 50, 47, 43 кДж/моль соответственно).
Валентные характеристики элементов группы меди (см. табл. 11.1) в общем сложны и, как ни странно, плохо изучены. Только в самое последнее время были синтезированы высшие фториды меди (IV), cepeбpa (V), золота (V и VII).
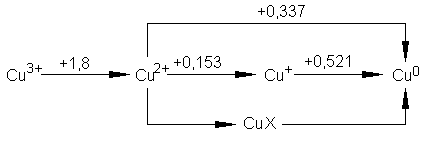
Сложность валентных отношений у элементов 11-й группы характеризуют диаграммы Латимера (значения ОВП даны в вольтах):
X¯ = Cl− |
+0,538 |
+0,137 |
Br− |
+0,640 |
+0,033 |
− |
+0,860 |
-0,1852 |
CN− |
+1,2 |
-0,43 |

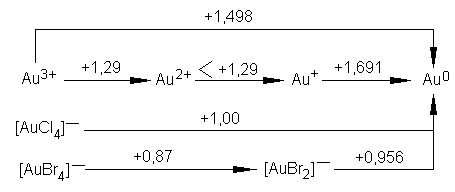
Из диаграмм видно, что наиболее стабильным для всех элементов группы меди является состояние со степенью окисления, равной нулю: все другие валентные формы термодинамически неустойчивы, равновесие смещено в сторону Э0.
С тепени
окисления этих элементов в самых
устойчивых соединениях, существующих
в водных растворах (+2 для меди, +1 для
серебра и +3 для золота), согласуются с
величинами ПИ: Ag
имеет минимальный ПИ1,
тогда как для Си минимальна сумма ПИ1
и ПИ2,
а для Аu
- сумма первых трех ПИ. Конечно, лишь
немногие из соединений элементов 11-й
группы являются ионными. По-видимому,
главным фактором, объясняющим эту
валентную
аномалию,
можно считать
размер атомов. Так, меньший размер и
больший заряд иона Сu2+
по сравнению с Сu+
обусловливает значительно большую
теплоту гидратации (~2100 и ~580 кДж/моль
соответственно), что делает состояние
Сu2+
в водных растворах более стабильным,
чем Сu+,
несмотря на устойчивую d10
-конфигурацию
последнего. В случае Ag
оба ионных радиуса (Ag+
и Ag2+)
больше и разница в теплотах гидратации
гораздо меньше, к тому же ПИ2
максимален в 11-й группе у серебра. Поэтому
более стабильным является ион Ag+
с 4d10-конфигурацией,
которая сформировалась уже у Pd,
предшествующего серебру в ПС. Устойчивость
золота
(III)
приписывают релятивистским эффектам,
действующим на 6s-электроны,
и высокой ЭСКП для плоскоквадратной
координации d8-ионов,
наиболее характерной у 5d-элементов.
В малоионизирующих растворителях самыми
устойчивыми являются соединения, где
элементы группы меди имеют степень
окисления + 1.
тепени
окисления этих элементов в самых
устойчивых соединениях, существующих
в водных растворах (+2 для меди, +1 для
серебра и +3 для золота), согласуются с
величинами ПИ: Ag
имеет минимальный ПИ1,
тогда как для Си минимальна сумма ПИ1
и ПИ2,
а для Аu
- сумма первых трех ПИ. Конечно, лишь
немногие из соединений элементов 11-й
группы являются ионными. По-видимому,
главным фактором, объясняющим эту
валентную
аномалию,
можно считать
размер атомов. Так, меньший размер и
больший заряд иона Сu2+
по сравнению с Сu+
обусловливает значительно большую
теплоту гидратации (~2100 и ~580 кДж/моль
соответственно), что делает состояние
Сu2+
в водных растворах более стабильным,
чем Сu+,
несмотря на устойчивую d10
-конфигурацию
последнего. В случае Ag
оба ионных радиуса (Ag+
и Ag2+)
больше и разница в теплотах гидратации
гораздо меньше, к тому же ПИ2
максимален в 11-й группе у серебра. Поэтому
более стабильным является ион Ag+
с 4d10-конфигурацией,
которая сформировалась уже у Pd,
предшествующего серебру в ПС. Устойчивость
золота
(III)
приписывают релятивистским эффектам,
действующим на 6s-электроны,
и высокой ЭСКП для плоскоквадратной
координации d8-ионов,
наиболее характерной у 5d-элементов.
В малоионизирующих растворителях самыми
устойчивыми являются соединения, где
элементы группы меди имеют степень
окисления + 1.
Из приведенных диаграмм Латимера видно, что комплексообразование и осаждение плохо растворимых соединений повышает стабильность неустойчивых валентных состояний. Например, переход Аu+ Аu0 в отсутствие иона Вr− характеризуется значением стандартного ОВП, равным +1,691 В, а в присутствии Вr− ОВП снижается до +0,956В. Связывание Ag+ в тиосульфатный комплекс понижает E0(Ag+/Ag0) от +0,8 В до +0,02 В, что стабилизирует серебро (I). Аналогичные примеры приведены ниже и для других систем. Принадлежность серебра и золота к драгоценным, или благородным, металлам обусловлена инертностью этих элементов в металлическом состоянии, что в свою очередь объясняется неустойчивостью их гетероатомных соединений.
В табл. 11.2. представлены важнейшие типы химических соединений элементов 11-й группы.
Таблица 11.2. Типичные гомо- и гетероатомные соединения элементов 11-й группы
Класс соединений |
Формула |
Элемент, образующий соединение |
Характерные свойства |
Простые вещества - металлы |
Э |
Сu - Аu |
Тугоплавкие вещества, максимальные электро- и теплопроводность, химически инертны, растворяются в кислотах - окислителях |
Оксиды |
Э2О |
Сu - Аu |
Нерастворимы в воде |
ЭО |
Сu, Аu |
Плохо растворимы в воде, растворяются в кислотах |
|
Э2О3 |
Au |
Устойчив до 1600С |
|
Гидраты оксидов |
ЭОН |
Сu - Аu |
Неустойчивые, мало растворимые в воде вещества, проявляют основные свойства |
Э(ОН)2
|
Сu
|
Проявляет амфотерные свойства с преобладанием основных |
|
Э(ОН)3 |
Au |
Проявляет амфотерные свойства с преобладанием кислотных |
|
Соли |
ЭХ |
Сu - Аu |
Низкая растворимость в воде галогенидов (кроме AgF), CuF не получен, для Ag известны соли кислородсодержащих кислот |
ЭХ2 |
Сu |
Устойчивость уменьшается от F к Br (CuI2 не получен); известны соли кислородсодержащих кислот |
|
ЭХ3 |
Au |
Устойчивость уменьшается от F к I |
|
Комплексные соединения |
[ЭL2]Хn |
Сu - Аu |
Имеют линейное строение, растворимы в воде |
Мn[ЭХ2] |
Сu - Au |
Имеют различную устойчивость. Растворимы в воде |
|
[ЭL4]Х2, М2[ЭХ4] |
Сu |
Комплексы квадратные или искаженные тетраэдрические |
|
М[ЭХ4] |
Аu |
Более устойчивы к гидролизу, чем простые соли |
X - анион кислородсодержащей или галогеноводородной кислоты, L - монодентатный лиганд.
