
- •1.Боевые свойства ов. Средства применения ob. Маркировка химических боеприпасов вероятного противника.
- •Боевые свойства
- •1.2 Токсичность
- •Классификация отравляющих веществ
- •2. Физические, химические и токсические свойства фов
- •2.1 Вещество gb - Зарин
- •2.2 Вещество gd - Зоман
- •2.3 Вещество VX
- •2.4 Другие вещества нервно - паралитического действия
- •Диизопропилфторфосфат
- •Алкилфторфосфонаты
- •2.5 Защита и дегазация фов. Защита от gb (зарин)
- •Защита от gd (зоман)
- •Защита от VX
- •3. Физические, химические и токсические свойства ов кожно-нарывного действия. Общая характеристика
- •3.1 Вещество hd – иприт
- •3.2 Другие вещества кожно-нарывного действия.
- •Вещество l – Люизит
- •Вещества hn-1. Hn-2, hn-3 - Азотистые иприты.
- •3.3. Защита и дегазация ов кожно-нарывного действия. Защита от hd (иприт).
- •4. Физические, химические и токсические свойства ов общеядовитого действия и защита от них.
- •4.1 Вещество ас - синильная кислота
- •4.2 Вещество ск
- •4.3 Другие вещества общеядовитого действия
- •Мышьяковистый водород AsH3 Мол. Масса 77,95
- •Фосфористый водород рн3 Мол. Масса 34
- •Окись углерода
- •Защита от ас
- •5. Физические, химические и токсические свойства ов удушающего действия и защита от них.
- •5.1 Вещество cg - фосген.
- •5.2. Другие вещества удушающего действия
- •Дифосген
- •Фториды хлора и серы
- •5.3. Защита от cg.
- •6. Характеристика раздражающих веществ (иритантов).
- •6.1 Вещество cs
- •6.2. Вещество cr
- •6.3. Другие вещества раздражающего действия Вещество ps
- •Вещество cn
- •Вещество dm
- •Арсины раздражающего действия
- •Природные раздражающие вещества и их синтетические аналоги
- •7. Характеристика психотропных веществ (инкапаситантов).
- •7.1 Вещество bz
- •7.2 Вещество lsd
- •7.3 Другие инкапаситанты
- •8. Бинарные системы химического оружия
- •8.1. Общая характеристика
- •8.2. Требования к реакциям в бинарных боеприпасах
- •8.3. Компоненты снаряжения gb-2 и gd-2
- •8.4. Компоненты снаряжения VX-2
- •8.5. Оценка бинарных систем химического оружия
- •9. Токсины
- •9.1. Общая характеристика
- •9.2. Классификация токсинов
- •9.3. Особенности строения и свойств токсинов
- •9.4. Ботулинические токсины и вещество хr
- •9.5. Стафилококковые энтеротоксины и вещество pg
- •9.6. Оценка токсинов
2.3 Вещество VX
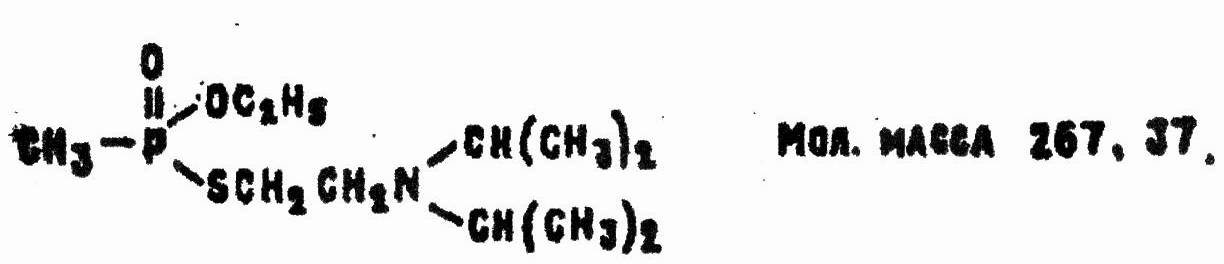
Химические названия: О-этиловый S-2-(N,N-диизопропиламино)этиловый эфир метилфосфоновой кислоты; O-этил-S-2-(N,N-диизопропиламино)этилметилтиолфосфонат.
Условные названия и шифры: VX (США); вещество группы А (Франция); вещество группы F (Швеция).
С начала 50-х годов в Великобритании в поисках эффективных инсектицидов антихолинэстеразного действия изучался ряд О,S-эфиров фосфорной кислоты, содержащих в своем составе диалкиламиноэтилтиогруппу. В 1955 г. под названием «амитон» был описан O,O-диэтил-S-2-(N, N-диэтиламино)этилтиолфосфонат,
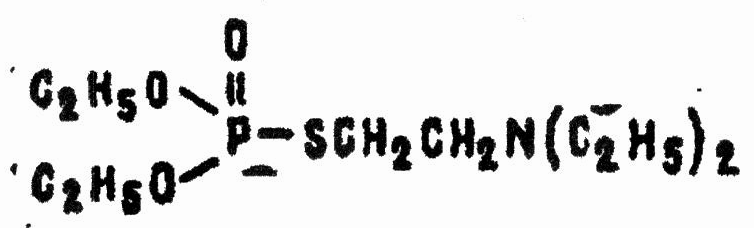
оказавшийся по токсичности сравнимым с зарином. Из-за структурного подобия ацетилхолину соединения этого ряда были названы фосфорилтиохолинами.
Высокая токсичность полученных фосфатов для теплокровных животных определила направление изысканий во всех развитых капиталистических странах. Приблизительно в одно время (1955 - 1960 гг.) появились публикации о подобных соединениях в Великобритании, ФРГ, Швеции. Параллельно начали работать военные исследователи в США и Канаде. К 1958 г. было установлено, что некоторые фосфорилтиохолины — производные алкилфосфоновых кислот - более токсичны, чем их фосфорнокислые аналоги.
Новый класс соединений получил в США Великобритании, Канаде и Нидерландах шифр V-газов в отличие от G-газов, объединявших фторангидриды алкиловых эфиров метилфосфоновой кислоты. К V-газам были отнесены фосфаты и главным образом фосфонаты общей формулы:

где R — алкил или алкоксигруппа, R' и R" — алкил.
Конкретные соединения в зависимости от значений R, R' и R" зашифрованы как агенты VE,VG,VM,VS,VX:

Вещество VX по совокупности токсических и физико-химических свойств было признано наиболее эффективным и принято на вооружение армии США. По зарубежным данным, промышленное производство VX организовано с апреля 1961 г. в Ньюпорте (штат Индиана).
Вещество VX — одно из основных отравляющих веществ смертельного действия, предназначенное для уничтожения живой силы противника. Считается, что в виде тонкодисперсного аэрозоля VX эффективно действует через органы дыхания. В виде грубодисперсного аэрозоля и капель VX действует через кожные покровы и одежду. В связи с этим VX в США рассматривается как отравляющее вещество, способное нанести поражение живой силе, защищенной противогазами. Вещество VX на длительное время заражает местность, вооружение, военную технику и открытые источники воды.
Веществом VX снаряжают табельные боеприпасы группы А. На вооружении армии США состоят 155-мм и 203,2-мм химические снаряды с неконтактными взрывателями, предназначенные для применения ствольной артиллерией, а также 155-мм химические снаряды для реактивных пусковых установок. Для заражения местности каплями и грубодисперсным аэрозолем предназначены химические фугасы, обеспечивающие разброс ОВ в радиусе около 10м. На вооружении ВВС США состоят сливные авиационные ппибопы в снаряжении VX.
Боеприпасы кодируются тремя зелеными кольцами и маркируются надписью «VX GAS».
Токсические свойства
Подобно другим ФОВ, вещество VX действует главным образом на фермент ацетилхолинэстеразу, поэтому вызываемые им признаки поражения не отличаются от признаков поражения веществами GB и GD, хотя и развиваются несколько медленнее. Время начала симптоматики зависит прежде всего от количества ОВ, попавшего в организм.
При вдыхании аэрозоля VX признаки поражения начинают проявляться относительно быстро. Относительная ингаляционная токсичность VX LCτ50 0,01 мг·мин/л, при этом период скрытого действия составляет 5 - 10 мин. Он не превышает 10 мин даже при концентрациях, соответствующих значению LCτ50 0,005 мг·мин/л. Миоз наступает при концентрации 0,0001 мг/л через 1 мин.
Таким образом, VX следует отнести к быстродействующим ОВ.
По сравнению с другими ФОВ для VX характерна более высокая кожно-резорбтивная токсичность и быстрое всасывание через кожные покровы. Считают, что средняя смертельная токсодоза VX при резорбции LD50 0,1 мг/кг. Однако величина LD изменятся в определенных пределах в зависимости от величины зараженной поверхности, времени экспозиции и даже от участков тела, на которые попало жидкое ОВ, и их состояния. Наиболее чувствительны к действию VX кожа лица и шеи. Симптоматика начинает проявляться через 1-24 ч, однако, если ОВ попадет в глаза, на губы или на поврежденную кожу, действие его проявляется очень быстро. При резорбции VX первым признаком поражения может быть не миоз, а мелкие подергивания кожи в местах контакта ее с ОВ.
Вещество VX опасно и при попадании на одежду. По американским данным, 95 мг жидкого VX, попавшего на летнее армейское обмундирование, достаточно, чтобы через 8 ч его ношения организм получил через кожу значение LD50. Первые признаки отравления жидким ОВ через одежду наступают спустя 3-24 ч после заражения.
Токсическое действие VX через кожу может быть усилено веществами, которые сами по себе практически нетоксичны, но обладают свойством быстрого всасывания в кровяное русло. В 60-е гг. в США и Канаде было исследовано свыше 200 подобных веществ, из которых диметилсульфоксид и N,N-диметиламид пальмитиновой кислоты оказались очень эффективными. Опыты на кроликах в Эджвудском арсенале США показали, что гибель животного после контакта с одной каплей смеси VX с диметилсудьфоксидом наступает вдвое быстрее, чем от такой же капли одного VX.
Опасно воздействие на незащищенную кожу VX в состоянии пара и тонкодисперсного аэрозоля. В этом случае значение LCτ50 составляет приблизительно 1 мг·мин/л. Смертельная доза VX при попадании в желудочно-кишечный тракт LD50 0,07 мг/кг.
Подобно другим ФОВ, вещество VX обладает кумулятивными свойствами.
Физические свойства
Химически чистое вещество VX представляет собой бесцветную жидкость, напоминающую по своей подвижности глицерин. Технические продукты имеют окраску от желтой до темно-коричневой и по консистенции походят на моторные масла. Плотность VX 1,0083 г/см3 при температуре 25 °С, плотность пара по воздуху 9,2. Вещество гигроскопично, ограниченно растворимо в воде (около 5% при температуре 20 °С), смешивается с органическими растворителями. Растворимость его в жирах выше, чем вешеств GB и GD.
Вещество VX — высококипящее соединение, не перегоняющееся при атмосферном давлении. Расчетная точка кипения 298 °С. Давление насыщенного пара при температуре 25 °С 0,0007 мм рт. ст., благодаря чему при этой температуре создается максимальная концентрация пара 0,0105 мг/л. В связи с такой низкой летучестью наиболее вероятно применение VX в виде капель и аэрозоля, так как создать опасную концентрацию пара практически невозможно или возможно только в районах с очень жарким климатом. Низкая температура замерзания VX (Тпл -39 °С) позволяет применять его в холодное время года.
Вещество VX легко проникает в пористые материалы, в ткани, растения, что затрудняет его дегазацию. В последующем возможна его обратная диффузия из пор и опасное вторичное заражение поверхностей.
Химические свойства
Соединение химически очень устойчиво, хотя имеет несколько реакционных центров. Электрофильный атом фосфора позволяет VX взаимодействовать с нуклеофильными реагентами. Однако в силу значительно меньшей электроотрицательности аминоэтилтиольной группы SCH2CH2NR2 по сравнению с атомом фтора в молекулах G-газов дефицит электронов у атома фосфора в V-газах меньше и его частичный положительный заряд значительно меньше, чем у веществ GE и GD. Кроме того, атаке нуклеофильных реагентов мешает объемный атом серы непосредственно связанный с атомом фосфора. В связи с этим все нуклеофильные реакции у VX происходят намного медленнее, чем у GB и даже у GD. Они имеют место преимущественно в неводных средах.
Из-за наличия координационно ненасыщенных атомов серы и азота, имеющих свободные пары электронов, VX ведет себя скорее как нуклеофильный реагент, поэтому в водных растворах предпочтительно взаимодействует с электрофильными веществами. Чем больше основность V-газа, которая обусловливается главным образом структурой заместителей при азоте, тем соединение устойчивее против нуклеофильных веществ Вещество VX, в частности, относится к наиболее химически стабильным в ряде различных V-газов. Оно настолько медленно реагирует с нуклеофильными молекулами, что эти реакции не имеют практического значения для целей дегазации.
Наименее прочной в молекуле VX является связь фосфор — сера. Она еще более ослабевает после присоединения электрофильного иона к атому серы, поэтому реакции VX происходят в основном с разрывом этой связи.
Нуклеофильные реакции
Вещество VX очень устойчиво к действию воды. При комнатной температуре начало гидролиза удается установить лишь спустя несколько часов после помещения ОВ в воду. Время разложения водой на 50% в нейтральной среде при температуре 25 °С вставляет 350 сут и даже при рН = 10 оно не менее 10 ч. Полное разложение ОВ достигается только при кипячении его с достаточно концентрированными растворами делочей (рН > 12). Время гидролиза наполовину при 25 °С и рН = 13 составляет 16 мин, а при pН = 14 - 1,З мин.
В нейтральной и слабощелочной среде гидролиз происходит главным образом с разрывом связи фосфор—сера:
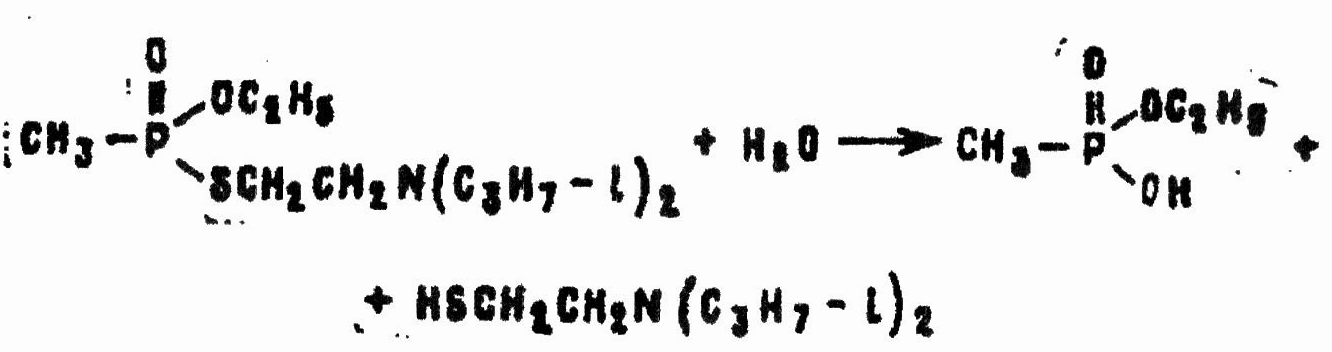
При pH > 10 возможен отрыв и эфирной группы:
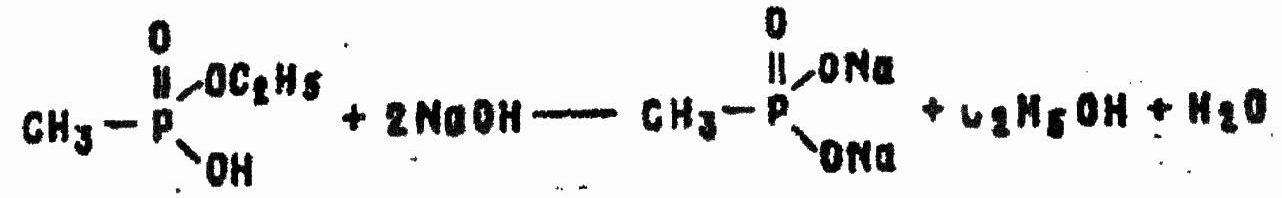
Продукты гидролиза нетоксичны.
В кислой среде наблюдается некоторое ускорение гидролиза по сравнению с нейтральной средой: при рН = 2—3 вещество разлагается на 50% за 100 сут. Причиной этого явления считают образование водорастворимого четвертичного аммониевого производного VX. Положительно заряженный атом азота оттягивает на себя электроны с фосфонильного кислорода, что ведет к увеличению частичного положительного заряда на фосфоре:
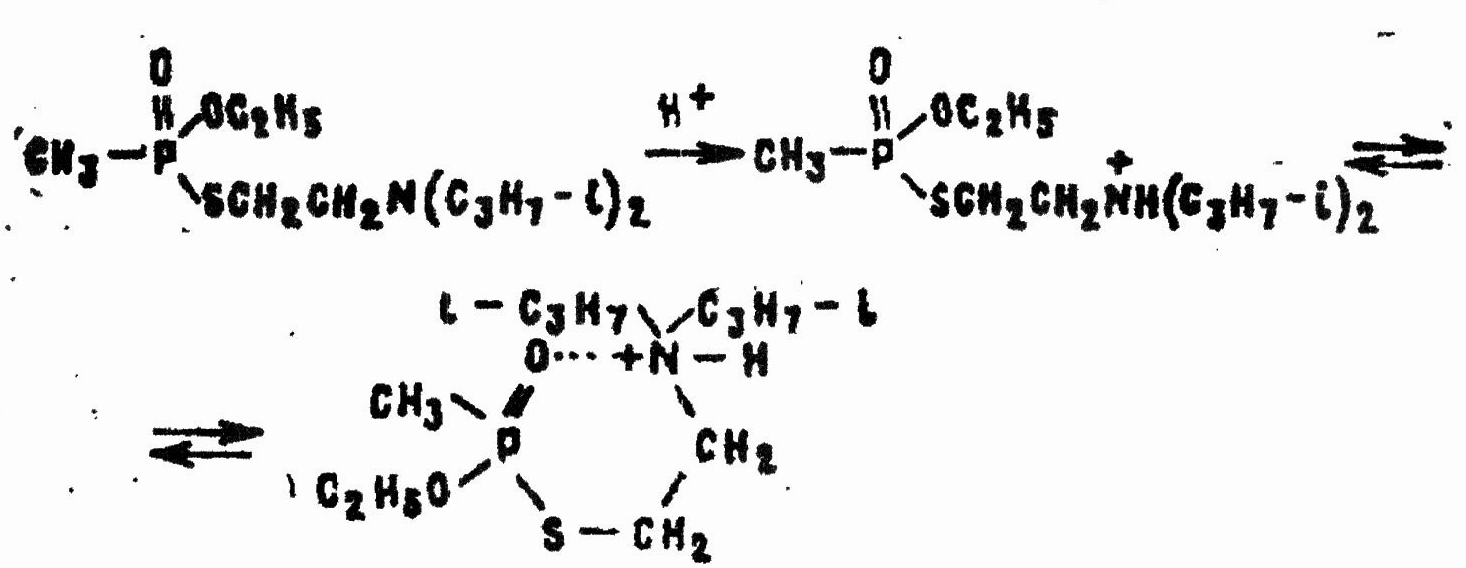
Применяемые для разложения G-газов феноляты щелочных металлов, ионы гипохлоритов, оксимы, гидроксамовые кислоты и другие нуклеофильные вещества реагируют с VX в водной среде настолько медленно, что эти реакции не имеют практического значения.
В неводной среде в подходящих органических растворителях VX сравнительно легко вступает в реакции с алкоксианионами щелочных алкоголятов алифатических спиртов, особенно если они замещены амино- или алкоксигруппами. Происходит обмен аминоалкилтиогруппы VX на эфирную группу с образованием нетоксичных средних эфиров метилфосфоновой кислоты:

Так, 0,5 М раствор аминоэтилата лития H2NCH2CH2OLi в смеси 75% моноэтаноламина с 25% гексан-1,6-диола практически нацело разлагает VX в течение 15 мин. Эту реакцию можно использовать для подбора рецептур, дегазирующих VX на кожных покровах, одежде. В качестве эффективных компонентов подобных рецептур могут участвовать алкоголяты алифатических спиртов в сочетании с диаминами и особенно растворы алкоголятов целлозольвов в целлозольвах.
Электрофильные реакции
Свойства VX как нуклеофильиого реагента обусловлены наличием свободных пap электронов на атомах азота и серы, благодаря которым ОВ обладает основностью по отношению к иону водорода и нуклеофильностью по отношению к другим соединениям. Конечно, основность и нуклеофильность у атомов азота и серы различны, поэтому в одних реакциях VX выступает как типичное основание, а в других — как нуклеофильный реагент.
С кислотами VX реагирует как основание и очень легко образует твердые аммониевые соли, растворимые в воде, спирте и многих полярных органических растворителях:
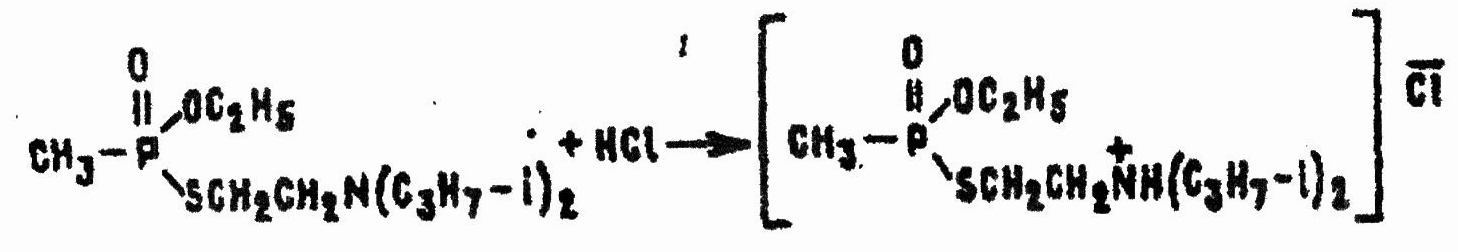
Продукты реакции по токсичности такие же, как и исходное ОВ, но они несколько быстрее гидролизуются, а главное — намного хуже проникают через кожу в кровяное русло. Этим можно воспользоваться для удаления VX с рук или поверхностей некоторых мелких предметов: достаточно обработать их раствором относительно сильной, но не слишком агрессивной к данной поверхности кислоты (например щавелевой или лимонной) и смыть образовавшуюся твердую ядовитую соль водой или подходящим растворителем. Ряд солей (например, соль VX с висмутйодистоводородной сислотой HBiI4) имеют характерную окраску, что используется в индикации отравляющих веществ группы V-газов.
Некоторые галоидные алкилы также взаимодействуют с VX с образованием твердых галоидалкилатов — четвертичных аммониевых солей, по токсичности превосходящих VX, но смываемых водой или спиртом, например:
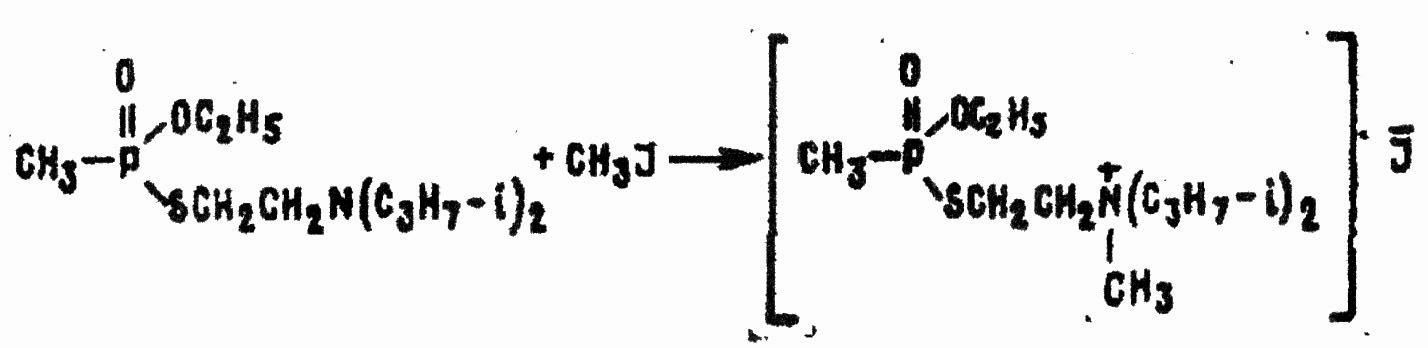
Реакции VX с электрофильными реагентами происходят по схеме электрофильного присоединения к атому серы с образованием сульфониевых производных:
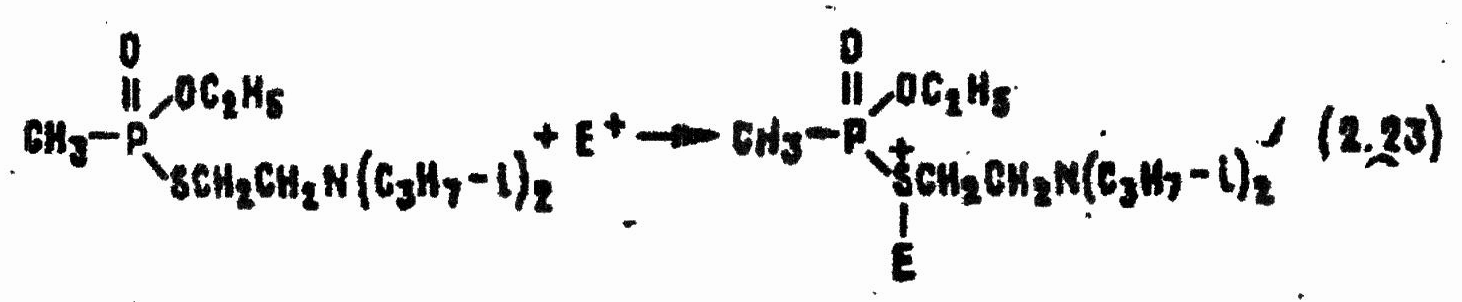
В продуктах присоединения связь Р—S ослабляется из-за смещения электронов, образующих ее, к положительно заряженному атому серы. Это влечет за собой увеличение дефицита электронной плотности на атоме фосфора и возрастание частичного положительного заряда. В итоге продукт реакции (2.23) легко подвергается нуклеофильной атаке, например, молекулой воды:
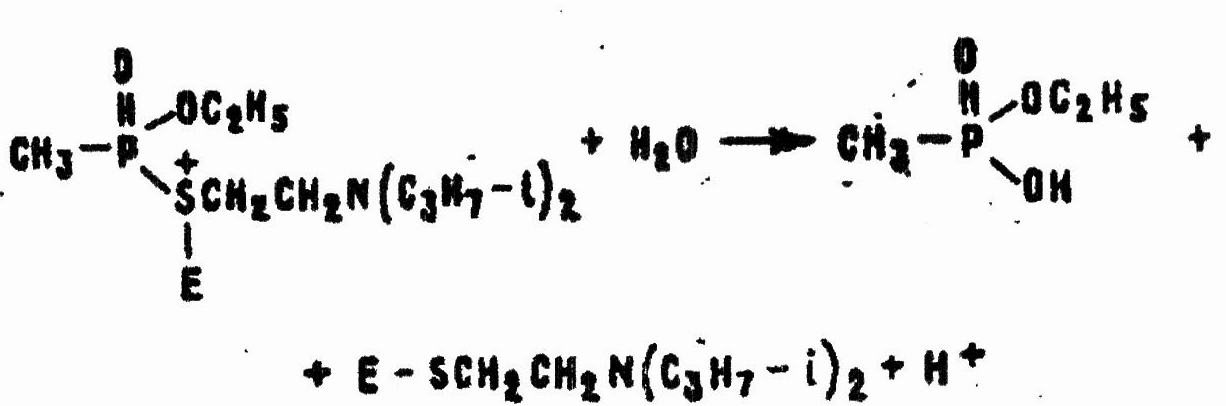
Электрофильные реакции в водных растворах лучше всего происходят при рН = 5—9. В частности, окислители взаимодействуют с VX с разрывом связи Р—S и образованием нетоксичных производных метилфосфоновой и эта нсульфо новой кислот по общей схеме:

По приведенной схеме реагируют любые окислители: хлор в водном растворе, хлорамины, гипохлориты, перекись водорода и т. д. От природы окислителя зависит главным образом скорость реакции. На глубину же окисления влияют среда, температура и продолжительность реакции, соотношение компонентов.
Реакция VX с гипохлоритами щелочных и щелочноземельных металлов в отличие от реакции G-газов сильно зависит от концентрации водородных ионов и содержания катионов хлора Cl+ и в значительно меньшей степени от содержания ионов гипохлорита ClO-. В водных растворах гипохлоритов, имеющих слабокислую или нейтральную среду, VX взаимодействует сначала с катионом хлора:

Промежуточное соединение быстро гидролизуется с образованием этилового эфира метилфосфноновой кислоты и диизопропиламиноэтансульфенхлорида:
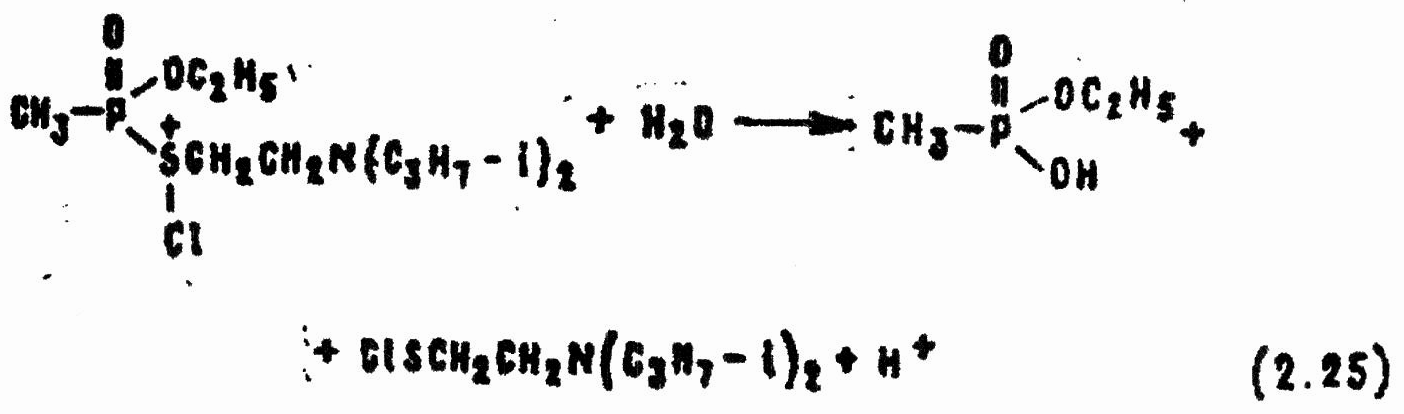
Последний также гидролитически неустойчив, но при достаточно высокой концентрации протонов в реакционной среде успевает прореагировать с другой молекулой VX, образуя сложное и нестабильное сульфониевое производное, гидролиз которого приводит к этилметилфосфонату и дисульфиду:
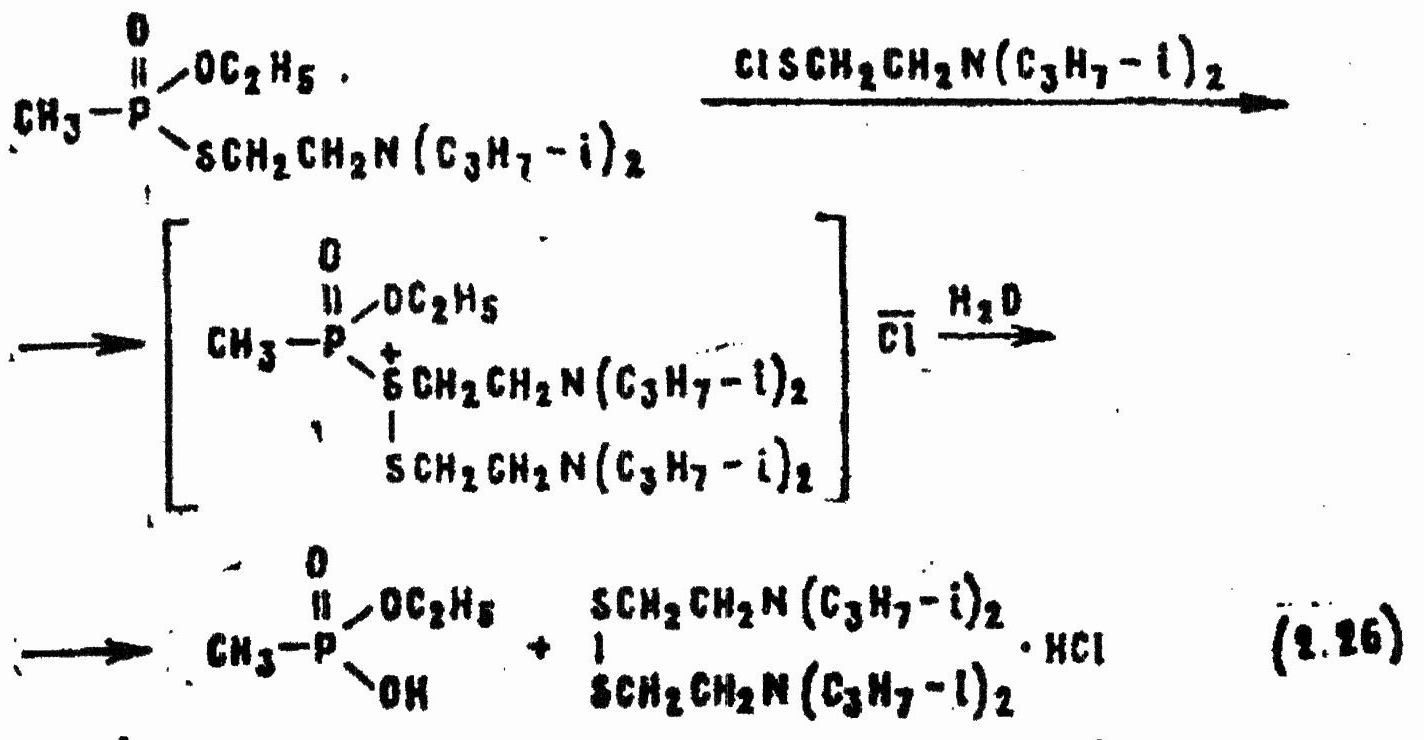
Дисульфид в условиях реакции окисляется до сульфохлорида, который сразу гидролизуется:
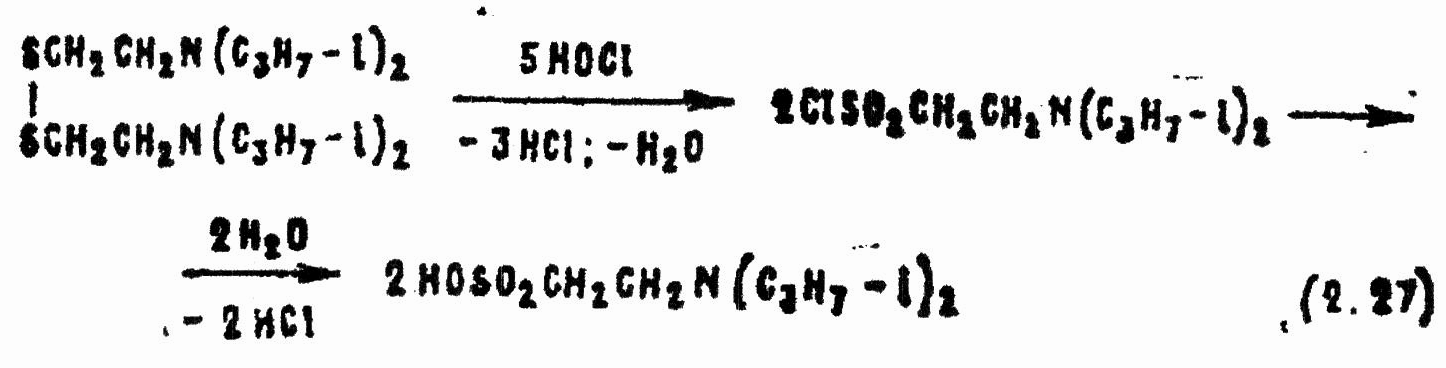
Реакции (2.24—2.27) требуют повышенного расхода гипохлорита, но слабокислой среде имеют достаточно высокую скорость и могут применяться для дегазации VX.
В щелочной среде катионы хлора отсутствуют, и реакция при комнатной температуре происходит медленнее:
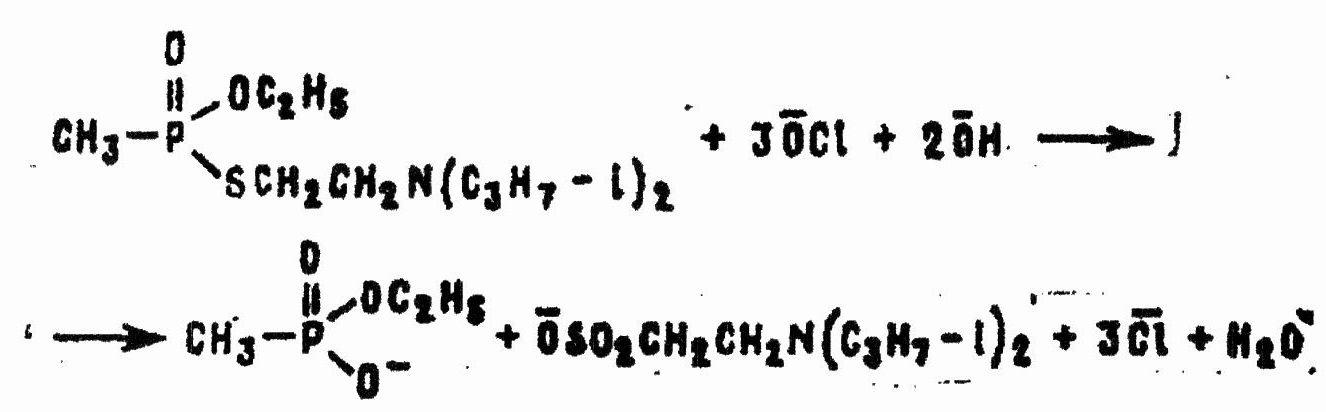
Применительно к ДТС ПС уравнение принимает вид:

Хлорамины и другие вещества хлорирующего и окислительного действия в зависимости от их силы и условий реакции по-разному реагируют с VX. Водорастворимые монохлорамины в нормальных условиях непригодны для разложения VX из-за их недостаточной активности как окислителей. Они реагируют с VX только в кислых водных растворах, при достаточно высокой концентрации водородных ионов.
Хлорамины, нерастворимые в воде (дихлорамины, гексахлормеламин), хлористый сульфурил, хлор и другие хлорирующие средства в подходящих органических растворителях количественно разлагают VX на хлорангидрид этилового эфира метилфосфоновой кислоты и 2-диизопропиламинозтансульфенхлорид:
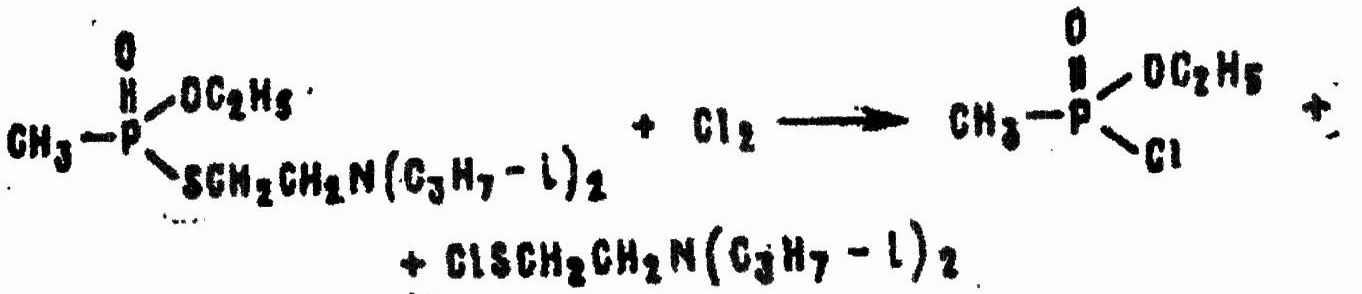
Продукты реакции нетоксичны и легко гидролизуются.
Термическая устойчивость
Вещество VX термически нестабильно, хотя устойчиво к детонации и кратковременному тепловому воздействию при разрыве химических боеприпасов. При нагревании разложение начинается примерно при температуре 150 °С (время пиролиза наполовину около 1,5 сут), а при температуре около 200 °С оно становится значительным. Время пиролиза наполовину составляет при температуре 200 °С 1,6 ч, при 250 °С — 4 мин, а при 295 °С — всего 36 с, поэтому при атмосферном давлении ОВ не перегоняется. При необходимости его очищают перегонкой в глубоком вакууме, например при температуре 80 °С и остаточном давлении 0,1 мм рт. ст.
Соединение не требует особых условий хранения, кроме герметизации емкостей.
