
- •1.Боевые свойства ов. Средства применения ob. Маркировка химических боеприпасов вероятного противника.
- •Боевые свойства
- •1.2 Токсичность
- •Классификация отравляющих веществ
- •2. Физические, химические и токсические свойства фов
- •2.1 Вещество gb - Зарин
- •2.2 Вещество gd - Зоман
- •2.3 Вещество VX
- •2.4 Другие вещества нервно - паралитического действия
- •Диизопропилфторфосфат
- •Алкилфторфосфонаты
- •2.5 Защита и дегазация фов. Защита от gb (зарин)
- •Защита от gd (зоман)
- •Защита от VX
- •3. Физические, химические и токсические свойства ов кожно-нарывного действия. Общая характеристика
- •3.1 Вещество hd – иприт
- •3.2 Другие вещества кожно-нарывного действия.
- •Вещество l – Люизит
- •Вещества hn-1. Hn-2, hn-3 - Азотистые иприты.
- •3.3. Защита и дегазация ов кожно-нарывного действия. Защита от hd (иприт).
- •4. Физические, химические и токсические свойства ов общеядовитого действия и защита от них.
- •4.1 Вещество ас - синильная кислота
- •4.2 Вещество ск
- •4.3 Другие вещества общеядовитого действия
- •Мышьяковистый водород AsH3 Мол. Масса 77,95
- •Фосфористый водород рн3 Мол. Масса 34
- •Окись углерода
- •Защита от ас
- •5. Физические, химические и токсические свойства ов удушающего действия и защита от них.
- •5.1 Вещество cg - фосген.
- •5.2. Другие вещества удушающего действия
- •Дифосген
- •Фториды хлора и серы
- •5.3. Защита от cg.
- •6. Характеристика раздражающих веществ (иритантов).
- •6.1 Вещество cs
- •6.2. Вещество cr
- •6.3. Другие вещества раздражающего действия Вещество ps
- •Вещество cn
- •Вещество dm
- •Арсины раздражающего действия
- •Природные раздражающие вещества и их синтетические аналоги
- •7. Характеристика психотропных веществ (инкапаситантов).
- •7.1 Вещество bz
- •7.2 Вещество lsd
- •7.3 Другие инкапаситанты
- •8. Бинарные системы химического оружия
- •8.1. Общая характеристика
- •8.2. Требования к реакциям в бинарных боеприпасах
- •8.3. Компоненты снаряжения gb-2 и gd-2
- •8.4. Компоненты снаряжения VX-2
- •8.5. Оценка бинарных систем химического оружия
- •9. Токсины
- •9.1. Общая характеристика
- •9.2. Классификация токсинов
- •9.3. Особенности строения и свойств токсинов
- •9.4. Ботулинические токсины и вещество хr
- •9.5. Стафилококковые энтеротоксины и вещество pg
- •9.6. Оценка токсинов
6.3. Другие вещества раздражающего действия Вещество ps
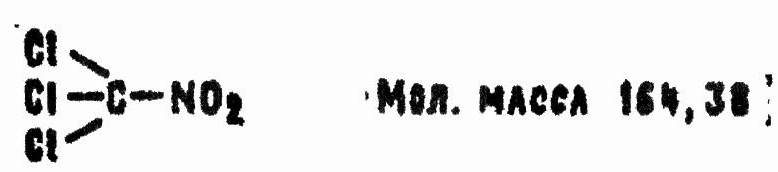
Химические названия: трихлорнитрометан; нитрохлороформ.
Условные названия и шифры: хлорпикрин; PS, Vomiting Gas (США); Klop (Германия).
Вещество PS впервые было получено в 1848 г. Дж. Стенгаузом (Великобритания), который и дал ему укоренившееся название «хлорпикрин». В середине 1916 г. хлорпикрин был успешно применен Германией в смеси с дифосгеном на поле боя. Он преодолевал применявшиеся в то время «влажные противогазы», поэтому вскоре начал производиться всеми воюющими странами.
Чаще всего PS применяли не самостоятельно, а в тактических смесях с маскирующими запах, дымообразующими и отравляющими веществами (с сероводородом, четыреххлористым оловом, хлором, фосгеном, дифосгеном). Появление угольных противогазов уже в первую мировую войну обесценило PS как боевое ОВ. Однако он до настоящего времени производится в промышленном масштабе и во многих армиях мира используется для обучения войск действиям в условиях химического заражения атмосферы, а также для проверки исправности и правильности подгонки противогазов. В армии США существует в качестве учебного ОВ раствор хлорацетофенона в хлорпикрине.
В мирных целях хлорпикрин применяют для фумигации почвы и зернохранилищ. Пар хлорпикрина в концентрации 0,8 мг/л вызывает гибель жуков амбарного долгоносика, а в концентрации 4 мг/л — 95% гибель малого мучного хрущака. Концентрация хлорпикрина 5 мг/л абсолютно смертельна для постельного клопа.
Хлорпикрин вызывает раздражение слизистых оболочек глаз и верхних дыхательных путей в концентрации 0,01 мг/л (у некоторых людей — 0,002 мг/л). Оно проявляется в виде жжения, рези и боли в глазах, смыкания век, слезотечения и мучительного кашля. Концентрация 0,05 мг/л является непереносимой и вызывает кроме приведенных признаков реакции рефлекторного характера в виде тошноты и рвоты. LCτ50 0,2 мг·мин/л. В дальнейшем развиваются быстро нарастающий отек легких, а также кровоизлияния во внутренних органах и в сердечной мышце Относительная токсичность при ингаляции LСτ50 20 мг·мин/л.
Вещество PS представляет собой бесцветную, сильно преломляющую свет жидкость с характерным резким запахом. Под действием света постепенно желтеет, затем приобретает желто-зеленую окраску. Плотность жидкости при температуре 20 ° 1,6579 г/см3, плотность пара по воздуху 5,7. Растворимость PS в воде 0,16% пр температуре 25 °С и уменьшается при нагревании. С большинством органически растворителей PS смешивается во всех соотношениях. Он растворяется также четыреххлористом олове, четыреххлористом кремнии, во многих ОВ (ФОВ, иприте, дифосгене и др.). Температура кипения 113 °С, давление насыщенного пара 18,31 мм р-ст. при температуре 20 °С, максимальная концентрация пара при этой температуре 18 мг/л, температура замерзания минус 69,2 °С.
В соответствии с химическим строением для PS возможны как реакции обмена атомов хлора и нитрогруппы на другие заместители, так и реакции восстановления азот или углерода. В реакциях обмена, из которых наиболее интересны гидролиз, действие щелочей и алкоголятов, PS малоактивен. Водой он практически не гидролизуется и даже при кипячении в течение 1 ч разлагается только 0,21% вещества. На ярком свету гидролиз несколько ускоряется и сопровождается образованием трех кислот; соляной азотистой и угольной:

Водные и разбавленные водно-спиртовые растворы кислот и щелочей также плохо реагируют с PS. Только при нагревании в спиртовых растворах щелочей происходит его полное разложение:
![]()
Поскольку в реакционной смеси содержатся алкоголят-анионы, побочно образуются соответствующие тетраалкиловые эфиры ортоугольной кислоты:
![]()
В случае использования спиртовых растворов алкоголятов натрия или калия последняя реакция становится основной и, поскольку хлор отщепляется количественно, она может применяться в аналитических целях.
Очень разнообразны реакции восстановления PS, которые могут осуществляться как по азоту, так и по углероду. Водно-спиртовой раствор сульфита натрия или раствор сернистого газа в спирте при комнатной температуре разлагают PS до нетоксичных веществ:
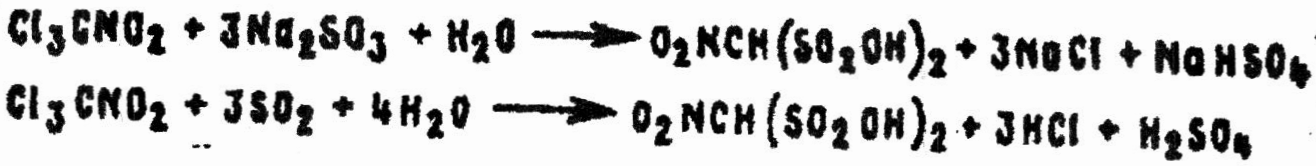
Реакция может найти применение для дегазации PS в закрытых помещениях и транспортных средствах.
Энергично происходит восстановление PS сернистым натрием в водных, водно-спиртовых, но лучше в спиртовых растворах в нейтральной или слабоосновной среде. Молекулы PS подвергаются при этом полной деструкции с выделением разнообразных твердых, жидких и газообразных продуктов: нитрита и хлорида натрия, серы, сероуглерода, сероокиси углерода, азота и его окислов, окиси и двуокиси углерода:

Обработку PS растворами сернистого натрия можно рекомендовать для его дегазации. В отсутствие спирта для этих целей пригодны водные растворы сульфида натрия, однако в этом случае необходима добавка поверхностно-активных веществ.
Хлорпикрин разлагается при нагревании, он также неустойчив к детонации. При кипячении PS скорость его термической деструкции составляет около 1% в сутки. При нагревании до температуры 400—500 °С пиролиз происходит количественно:

В этих условиях оба продукта реакции частично разлагаются дальше:

Об образовании фосгена при термическом разложении хлорпикрина необходимо всегда помнить в случаях использования последнего для технической проверки правильности подгонки противогазов.
Надежной зашитой от PS служит противогаз. Для дегазации ОВ пригодны водно-спиртовые или водные (с добавкой поверхностно-активных веществ) растворы сернистого натрия. В отдельных случаях PS может быть удален из помещений проветриванием.
