
- •1.Боевые свойства ов. Средства применения ob. Маркировка химических боеприпасов вероятного противника.
- •Боевые свойства
- •1.2 Токсичность
- •Классификация отравляющих веществ
- •2. Физические, химические и токсические свойства фов
- •2.1 Вещество gb - Зарин
- •2.2 Вещество gd - Зоман
- •2.3 Вещество VX
- •2.4 Другие вещества нервно - паралитического действия
- •Диизопропилфторфосфат
- •Алкилфторфосфонаты
- •2.5 Защита и дегазация фов. Защита от gb (зарин)
- •Защита от gd (зоман)
- •Защита от VX
- •3. Физические, химические и токсические свойства ов кожно-нарывного действия. Общая характеристика
- •3.1 Вещество hd – иприт
- •3.2 Другие вещества кожно-нарывного действия.
- •Вещество l – Люизит
- •Вещества hn-1. Hn-2, hn-3 - Азотистые иприты.
- •3.3. Защита и дегазация ов кожно-нарывного действия. Защита от hd (иприт).
- •4. Физические, химические и токсические свойства ов общеядовитого действия и защита от них.
- •4.1 Вещество ас - синильная кислота
- •4.2 Вещество ск
- •4.3 Другие вещества общеядовитого действия
- •Мышьяковистый водород AsH3 Мол. Масса 77,95
- •Фосфористый водород рн3 Мол. Масса 34
- •Окись углерода
- •Защита от ас
- •5. Физические, химические и токсические свойства ов удушающего действия и защита от них.
- •5.1 Вещество cg - фосген.
- •5.2. Другие вещества удушающего действия
- •Дифосген
- •Фториды хлора и серы
- •5.3. Защита от cg.
- •6. Характеристика раздражающих веществ (иритантов).
- •6.1 Вещество cs
- •6.2. Вещество cr
- •6.3. Другие вещества раздражающего действия Вещество ps
- •Вещество cn
- •Вещество dm
- •Арсины раздражающего действия
- •Природные раздражающие вещества и их синтетические аналоги
- •7. Характеристика психотропных веществ (инкапаситантов).
- •7.1 Вещество bz
- •7.2 Вещество lsd
- •7.3 Другие инкапаситанты
- •8. Бинарные системы химического оружия
- •8.1. Общая характеристика
- •8.2. Требования к реакциям в бинарных боеприпасах
- •8.3. Компоненты снаряжения gb-2 и gd-2
- •8.4. Компоненты снаряжения VX-2
- •8.5. Оценка бинарных систем химического оружия
- •9. Токсины
- •9.1. Общая характеристика
- •9.2. Классификация токсинов
- •9.3. Особенности строения и свойств токсинов
- •9.4. Ботулинические токсины и вещество хr
- •9.5. Стафилококковые энтеротоксины и вещество pg
- •9.6. Оценка токсинов
Защита от ас
Современный фильтрующий противогаз надежно защищает органы дыхания от воздействия АС. При длительном пребывании в атмосфере, зараженной АС, особенно в закрытых помещениях, где могут быть созданы высокие концентрации вещества, необходимо пользоваться защитной одеждой.
При поражении АС следует применить антидот, например амилнитрит. Раздавленную ампулу с антидотом быстро вводят под лицевую часть противогаза, при необходимости делают искусственное дыхание. Следует помнить, что при вдыхании содержимого одной ампулы антидота до 20% гемоглобина крови превращается в метгемоглобин, не участвующий в переносе кислорода от легких к тканям. Поэтому при оказании первой помощи пораженному рекомендуется использовать не более двух ампул с амилнитритом.
В лечебных учреждениях дополнительно к амилнитриту внутривенно вводят метиленовую синь в физиологическом растворе или в растворе глюкозы, 25—30% раствор тиосульфата натрия, диоксиацетон. Комплексная антидотная терапия позволяет снять токсическое действие не менее десяти смертельных доз АС.
Пораженным синильной кислотой показаны кислородотерапия, способствующая окислению ОВ, и средства, стимулирующие сердечную деятельность, типа камфоры, адреналина, кофеина, кардиазола. Синильную кислоту, попавшую на кожу, смывают 2% раствором соды или водой с мылом.
Для дегазации АС пригодны водные суспензии, приготовленные из 20% едкого натра и 10% раствора железного купороса (1:2 по объему). Можно обработать АС щелочью, но образующийся при этом токсичный цианистый натрий целесообразно смешать с избытком окислителя, например 10% КМnO4.
5. Физические, химические и токсические свойства ов удушающего действия и защита от них.
5.1 Вещество cg - фосген.

Химические названия: дихлорангидрид угольной кислоты; карбонилхлорид, хлорокись углерода. Условные названия и шифры: фосген; D-Stoff (Германия); CG (США, Великобритания); Palite (Франция).
Токсические свойства
Фосген взаимодействует с нуклеофнльными функциональными группам липидов и структурных белков мембран клеток, образующих стенки легочных альвеол. Это приводит к местному повышению проницаемости легочных капилляров и альвеол, результате альвеолы заполняются плазмой крови; нормальный газообмен в легкие нарушается. Недостаток кислорода в легочной ткани и повышенная растворимость углекислого газа в выпотевшей плазме способствуют дальнейшему повышению проницаемости стенок капилляров. При отравлениях тяжелой степени более 30% плазмы крови переходит в легкие, которые разбухают и увеличиваются в массе с 500-600 г в нормальных условиях до 2,5 кг. Диффузия кислорода из легких в кровеносные капилляры затрудняется, кровь обедняется кислородом при одновременном увеличени содержания углекислого газа. Недостаток кислорода, потеря плазмы, повышенное содержание белковых молекул повышают вязкость крови почти вдвое. Эти изменения замедляют кровообращение и ведут к опасной перегрузке сердечной мышцы и падении кровяного давления. Токсический отек легких является причиной гибели организма из-за прекращения окислительно-восстановительных процессов в органах и тканях.
Смертельный исход обычно наступает на вторые-третьи сутки. Если это «критический» период миновал, то состояние пораженного постепенно начинает улучшаться, и через 2—3 недели может наступить выздоровление. В этот период крайне опасны осложнения из-за вторичных инфекционных заболеваний.
Непосредственное действие CG на клеточные мембраны капилляров и альвеол исключает возможность нахождения антидотов против этого ОВ; лечение пораженных симптоматическое.
Будучи весьма активным ацилирующим реагентом, CG обладает некоторые раздражающим действием на глаза и слизистые оболочки.
Признаки токсического отека легких проявляются после периода скрытой действия, продолжающегося в среднем 4—6 ч. В зависимости от дозы CG, состояния и физической нагрузки пораженных продолжительность периода скрытого действия может сокращаться до 2— 3 ч или увеличиваться до 15 ч. В целом короткий латентный период служит неблагоприятным прогностическим признаком и свидетельствует с более тяжелом поражении. В течение всего периода скрытого действия пораженные не ощущают никаких признаков отравления, чувствуют себя вполне работоспособными и, продолжая оставаться в отравленной атмосфере, могут успеть вдохнуть несколько смертельных доз CG. Коварство ОВ состоит еще в том, что первоначально чувствуется его запах, начиная от концентрации в воздухе 0,004 мг/л. Однако CG притупляет обонятельный нерв, после чего перестают ощущаться даже более высокие концентрации газа.
К концу периода скрытого действия возникают першение и жжение в носоглотке, позывы к кашлю. В последующем кашель усиливается, наступает одышка. Губы, нос, уши, конечности синеют, пульс становится реже. Развивающийся отек легких ведет к сильному удушью, мучительному давлению в грудной клетке. Частота дыхания возрастает с 16 вдохов в минуту в спокойном состоянии до 30—70 вдохов, при этом дыхание становится все более поверхностным, пульс учащается до 100 ударов в минуту. Происходит обильное выделение пенистой мокроты (иногда с кровью). Пораженные беспокойны, мечутся, хватают ртом воздух, но всякие движения еще более ухудшают состояние. Отек легких и угнетение дыхательного центра вызывают смертельный исход.
Вдыхание CG в концентрации около 0,004 мг/л в течение по крайней мере 1 ч не ведет к отравлению, однако влияет на вкусовые ощущения. Отмечается, например, отвращение к табачному дыму и запаху. При концентрации 0,5-7-0,6 мг/л и одноминутной экспозиции могут возникнуть легкие отравления, а при трех-, пятиминутной — отравления тяжелой степени. Относительная токсичность при ингаляции LCτ50 3,2 мг·мин/л.
В случае пребывания людей в атмосфере CG с концентрацией свыше 5 мг/л смерть может наступить через 2—3 с. В этом случае отека легких не развивается, возникает молниеносная форма гипоксии вследствие наполнения легких газом при почти полном отсутствии в воздухе кислорода.
Пораженный теряет сознание, падает и в судорогах погибает от паралича дыхательного центра. Учитывая физические свойства CG, создание высоких концентраций его при подходящих топографических и метеорологических условиях вполне возможно.
Фосген обладает кумулятивными свойствами, т. е. в организме накапливаются поражения от его несмертельных доз, способные в сумме привести к тяжелым отравлениям, вплоть до смертельных.
Физические свойства
Фосген представляет собой бесцветный газ с запахом прелого сена или гнилых яблок, плотность которого в 3,48 раза выше плотности воздуха. Плотность жидкого фосгена при температуре 0°С 1,4203 г/см3. Он ограниченно растворяется в воде, одновременно разлагаясь при этом. Считают, что растворимость CG в воде при температуре 20 °С составляет 0,9%. В органических растворителях, дизельном топливе, в жирах и маслах CG растворяется хорошо. Он растворим также во многих отравляющих и жидких дымообразующих веществах.
Точка кипения CG 8,2 °С, давление насыщенного пара 1178 мм рт. ст. при температуре 20 °С. Это обусловливает очень высокую летучесть отравляющего вещества, которая даже в зимнее время достаточна для достижения поражающих концентраций. Максимальная концентрация CG при температуре минус 20 °С составляет 1400 мг/л, а при температуре 20 °С — 6370 мг/л. Вещество застывает в белую кристаллическую массу при минус 118 °С,
Химические свойства
В отсутствие влаги дихлорангидрид угольной кислоты стабилен. Практически все его химические превращения основаны на нуклеофильном замещении атомов хлора на другие группы.
Газообразный CG почти не гидролизуется влагой воздуха, что и позволяет применять его для заражения атмосферы. Лишь в очень влажном воздухе облако CG за счет частичного гидролиза приобретает белесоватость.
Фосген, растворенный в воде, быстро гидролизуется даже при низкой температуре с образованием угольной и соляной кислот:
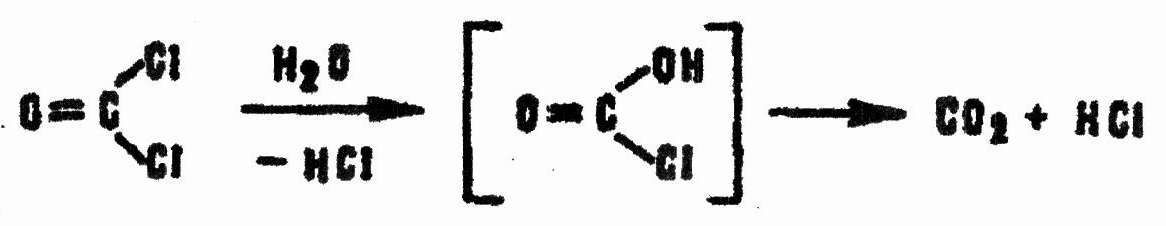
При температуре 0°С в 100 г воды за 20с разлагается 1 г CG. Щелочи сильно ускоряют реакцию:
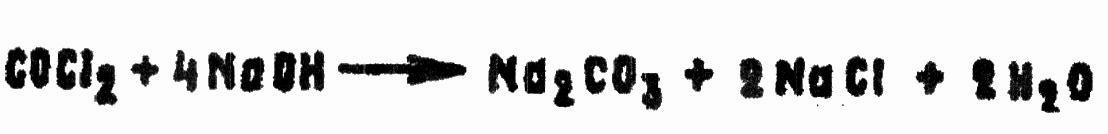
Фосген энергично реагирует как с жидким, так и с газообразным аммиаком с образованием нетоксичных мочевины и хлористого аммония:

Эту реакцию можно использовать для дегазации CG в местах застоя (низинах, закрытых помещениях) посредством распыления аммиачной воды. Однако к этой рекомендации следует подходить осмотрительно: по зарубежным данным, скорость разложения газообразного фосгена аммиачно-воздушной смесью меньше, чем можно было ожидать, и время полного уничтожения ОВ измеряется часами.
Легко происходят реакции фосгена с первичными и вторичными аминами. Например, с анилином количественно образуется дифенилмочевина:

Реакция используется в аналитических целях.
На получение мочевины и некоторых ее производных расходуется значительная доля всего производимого промышленностью фосгена. Мочевина используется как удобрение и добавка к кормам для жвачных животных. На ее основе получают мочевинно-формальдегидные смолы, меламин, циануровую кислоту, ряд лекарственных средств.
Другим направлением мирного использования фосгена является его взаимодействие с солями первичных аминов с образованием изоцианатов:
![]()
Органические изоцианаты алифатического и ароматического рядов служат промежуточными продуктами синтеза полиуретанов, которые применяются для производства пенопластов, волокон, искусственной кожи, эластомеров, лаков, клеев, герметиков. Достаточно сказать, что в 1980 г. мировое производство полиуретанов составило 3,6 млн т.
Третичные амины образуют с фосгеном продукты присоединения, разлагающиеся водой. Реакция с полициклическим гексаметилентетрамином (уротропином) в первую мировую войну лежала в основе защитного действия от фосгена так называемого «влажного противогаза» (ватно-тканевой маски, пропитанной раствором уротропина):

При взаимодействии CG с первичными и вторичными спиртами образуются эфиры угольной кислоты (карбонаты). При этом один атом хлора замещается быстро:

Продукты замещения одного атома хлора в фосгене низшими алифатическими спиртами (метиловым или этиловым) обладают сильным слезоточивым действием и в первую мировую войну применялись в качестве ОВ раздражающего действия. Метиловый эфир хлоругольной кислоты служит исходным продуктом для синтеза вещества DP (дифосгена).
Другой атом хлора замещается намного медленнее первого. В результате образуются устойчивые средние карбонаты:

В присутствии оснований (акцепторов хлористого водорода) можно заместить один или оба атома хлора в фосгене на остаток любого спирта или фенола. Так же легко реагируют алкоголяты или феноляты:

Способность фенолятов быстро образовывать сложные эфиры с фосгеном дает возможность использовать эти вещества в качестве поглотителей в средствах защиты органов дыхания.
Третичные спирты при взаимодействии с CG не превращают его в средний карбонат: промежуточно образующийся эфир хлоругольной кислоты разлагается с выделением хлористого алкила, например:
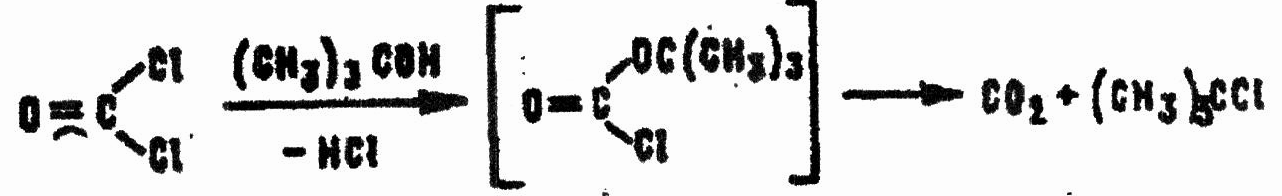
Как хлорангидрид кислоты CG вступает в реакцию Фриделя-Крафтса, образуя кетоны, что используется в синтезах красителей дифенил- и трифенилметанового ряда.
Реакция с йодистым натрием в безводном ацетона используется для количественного определения фосгена. Выделившийся свободный йод оттитровывают тиосульфатом натрия:
![]()
При температуре 200—400 °С фосген реагирует с окислами и сульфидами металлов, переводя их а хлориды, например:
![]()
Реакция используется для получения безводных хлоридов металлов. Хлорирующее действие фосгена объясняется его термической диссоциацией, которая начинается при температуре 200°С. При температуре 800 °С фосген полностью диссоциирует:
![]()
Однако при взрыве термическая деструкция CG незначительна, поэтому возможно его применение в боеприпасах взрывного типа.
