
2 Группы комплексообразователей:
Катионы d- и f-элементов (
 и
др.), некоторые p-элементы
в положительной степени окисления (
и
др.), некоторые p-элементы
в положительной степени окисления (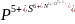 и др.), а также s-элементы
(
и др.), а также s-элементы
( и др.)
и др.)Нейтральные атомы d-элементов (Fe, Co, Ni), а также элементы благородных газов.
Наибольшей комплексообразующей способностью обладают d-элементы (в виде ионов или атомов).
Наименьшей компл-ей способностью обладают s-элементы.
Комплексообразователи-кислоты Льюиса.
Кислота Льюиса – это любое соединение, способное принять электронную пару на незаполненную орбиталь. Иначе, кислота Льюиса – акцептор пары электронов. К кислотам Льюиса относятся как обычные протонсодержащие кислоты (HCl, H2SO4 и др.), так и апротонные кислоты ZnCl2, FeBr3, BF3, AlCl3.
Строение Комплексных соединений с точки зрения теории Льюса.
Хотя в ряде простейших случаев теория Льюиса и дает некоторое представление о строении отдельных соединений, тем не менее в своем первоначальном виде она не приложима к химии комплексных соединений, так как максимально возможная валентность центрального атома с точки зрения этой теории оказывается равной четырем.
Согласно этой теории, все группы, входящие в состав комплексного соединения, располагаются определенным образом вокруг иона металла-ком'плексо-об'разователя, названного Веря ером центральным атомом *.
Воп.№32
Устойчивость комплексных соединений, их диссоциация, константа нестойкости, ее роль.
В
растворе комплексные соединения
диссоциируют на комплексный ион и ионы
внешней сферы. Эта диссоциация протекает
практически нацело, по типу диссоциации
электролитов, и называется первичной.
Лиганды связаны с центральным атомом
значительно прочнее и отщепляются в
незначительной степени – этот процесс
называется вторичной
диссоциацией, подчиняется закону
действующих масс и количественно
характеризуется константой
равновесия,
которая характеризует устойчивость
комплексных ионов в растворе и называется
константой
нестойкости
комплексов
 .
Чем
меньше константа нестойкости, тем
устойчивее комплексный ион. Величина,
обратная константе нестойкости,
называется константой устойчивости.
.
Чем
меньше константа нестойкости, тем
устойчивее комплексный ион. Величина,
обратная константе нестойкости,
называется константой устойчивости.
Лигандообменные равновесия:
Изолированные:
По типу сильных электролитов
По типу слабых электролитов
Совмещенные:
За лиганд
За комплексообразователь
(примеры на фото)
Воп.№33
Металлолигандный гомеостаз.
Для организма характерно поддержание на постоянном уровне концентрации веществ, участвующих в лиигандообменных равновесиях. В организме постоянно происходит образование и разрушение жизненно необходимых биокомплексов, которые состоят из металлов жизни и биолигандов.
Случаи, в которых возможно нарушение метало-лигандного баланса:
В организм поступают ионы-токсиканты из окружающей среды; наиболее опасные – ионы ртути, кадмия, таллия. Все они способны образовывать прочные комплексные соедиенния с биолигандами, серьезно нарушая при этом параметры стационарного состояния;
В организм поступают микроорганизмы, необходимые для жизни, но в больших количествах.
Нарушение гомеостаза возможно и в результате непоступления, или поступления в значительно меньших количествах, важнейших микроэлементов.
Нарушение концентраций ионов металлов возникает в результате связывания их в комплексы с попадающими извне токсичными лигандами.
В ряде случаев в организме образуются лиганды не свойственные ему в норме фальшивые лиганды). Такое явление называют лигандной паталогией.
При тех или иных отклонениях в метало-лигандном балансе организм включает защитные механизмы и со временем возвращает основные показатели к норме. Однако, в ряде случаев возникает необходимость в проведении фармакотерамии.
Принципы хелатотерапии.
Выведение ионов тяжелых металлов из организма под действием хелатирующих реагентов называется хелатотерапией.
Основные принципы хелатотерапии можно сформулировать в двух положениях. Вводимый детоксикант: а) должен эффективно связывать ионы-токсиканты; вновь образующиеся соединения должны быть прочнее, чем те, которые существовали в организме; б) не должен разрушать жизненно необходимые соединения; соединения, которые могут образовываться при взаимодействии детоксиканта и ионов биометаллов, должны быть менее прочными, чем существующие в организме.
Применение комплексонов в медико-санитарной практике.
Выполняют функцию противоядий (антидотов) при отравлении тяжелыми металлами.
Участвуют во многих сложных реакциях, вступая во взаимодействие с неорганическими биологическими соединениями. Так как в крови и других биосредах велика концентрация кальция, этот катион конкурирует с любыми из выводимых металлов за место в комплексе.
Комплексоны и их комплексы применяют при лечении различных металлоизбыточных и металлодефицитных состояний, связанных с заболеваниями, которые вызываются нарушениями обмена кальция, железа, меди и др. (рахит, психические заболевания, профилактика радиационных поражений).
Иногда длительное поступление в организм малых количеств ядовитых металлов приводит к их накоплению в различных внутренних органах и тканях, вследствие чего их концентрация в крови и моче существенно не повышена. Введение же комплексонов увеличивает выведение яда с мочой и тем самым указывает на его присутствие в организме. В таких случаях комплексоныможно использовать в целях диагностики. Иными словами, процесс комплексообразования приводит к нарушению установившегося равновесия между ионизированным металлом плазмы крови и металлом, содержащимся, например, в жировых тканях, а также в эритроцитах, печени, костной ткани и т.д.
Защита от газовой гангрены.
Комплексоны или их соли (тетацин, трилон Б) могут применяться при всех видах патологий, связанных с Са-избыточными состояниями.
