
- •1.Статистический и термодинамический методы
- •2.Молекулярно-кинетическая теория идеальных газов
- •2.1.Основные определения
- •2.2.Опытные законы идеального газа
- •2.3.Уравнение состояния идеального газа (уравнение Клапейрона-Менделеева)
- •2.5.Распределение Максвелла
- •2.6.Распределение Больцмана
- •3.Термодинамика
- •3.1.Внутренняя энергия. Закон равномерного распределения энергии по степеням свободы
- •3.2.Первое начало термодинамики:
- •3.3.Работа газа при изменении его объема
- •3.4.Теплоемкость
- •3.5.Первое начало термодинамики и изопроцессы
- •3.6.Круговой процесс (цикл). Обратимые и необратимые процессы. Цикл Карно.
- •3.7.Второе начало термодинамики
- •3.8.Реальные газы
- •3.8.1.Силы межмолекулярного взаимодействия
- •3.8.2.Уравнение Ван-дер-Ваальса
- •3.8.3.Внутренняя энергия реального газа.
- •3.8.4. Эффект Джоуля-Томсона. Сжижение газов.
2.2.Опытные законы идеального газа
Закон Бойля-Мариотта: при T=const, m=const pV = const (изотермический процесс , рис.1).
Закон Гей-Люссака: при p=const, m=const V=VoaT (изобарный процесс , рис.2), при V=const, m=const p=poaT (изохорный процесс , рис.3).
Закон Авогадро: моль любого газа при одинаковой температуре и давлении занимает одинаковый объем Vm (при нормальных условиях Vm = 22.41.10-3 м3).
Закон Дальтона: давление смеси газов равно сумме парциальных давлений р1, р2,... рn входящих в нее газов p = p1+p2+...+pn. Парциальное давление - давление, которое производил бы газ, входящий в состав газовой смеси, если бы он занимал объем, равный объему смеси при той же температуре.
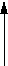
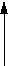

 p
V p
p
V p

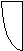


T2 p2 V2

 T1<T2
p1>p2
V1>V2
T1<T2
p1>p2
V1>V2
T1 p1 V1
V T T



Рис.1. Рис.2. Рис.3.
2.3.Уравнение состояния идеального газа (уравнение Клапейрона-Менделеева)
Функциональная связь между давлением, объемом и температурой называется уравнением состояния. Для идеального газа, используя законы Бойля-Мариотта, Гей-Люссака и Авогадро, можно получить:
уравнение Клапейрона-Менделеева для одного моля газа pVm = RT, (1a)
где R = 8.31 Дж/моль.К - газовая постоянная (она находится после подстановки в последнее уравнение нормальных условий)
уравнение Клапейрона-Менделеева для произвольной массы газа pV =(m/M)RT = nRT, (1b)
где М - масса одного моля (молярная масса), n = m/M - количество вещества.
Можно ввести постоянную Больцмана k = R/NA = 1.38.10-23 Дж/К и тогда уравнение Клапейрона-Менделеева имеет вид p = nkT, (1c)
где n = NA/Vm - число молекул в единице объема (концентрация молекул), т.е. при одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул (в 1 м3 при нормальных условиях содержится NL = 2.68.1025 молекул - число Лошмидта).
2.4.Основное уравнение молекулярно-кинетической теории идеальных газов выводится в предположении, что молекулы газа движутся хаотически, число взаимных столкновений между молекулами пренебрежимо мало по сравнению с числом ударов о стенки сосуда, а соударения молекул со стенками сосуда абсолютно упругие.
p = (1/3)nm<vкв>2, (2)
где
n = N/V - концентрация молекул газа, N - число
молекул газа, V - объем газа, <vкв>
= [(1/N)![]() vi2]1/2
- среднеквадратичная скорость молекул,
vi
- скорость i-молекулы, m - масса одной
молекулы.
vi2]1/2
- среднеквадратичная скорость молекул,
vi
- скорость i-молекулы, m - масса одной
молекулы.
Суммарная кинетическая энергия поступательного движения всех молекул газа E = N[m<vкв>2/2] и, следовательно, уравнение (2) можно записать pV = (2/3)E.
Если
сравнить уравнение (2) с уравнением
Клапейрона-Менделеева (1), то можно
получить выражения для среднеквадратичной
скорости
молекул <vкв>
=
![]() (3a)
(3a)
и для средней кинетической энергии поступательного движения одной молекулы идеального газа
<Ek> = 3kT/2. (4)
Таким образом, термодинамическая температура Т является мерой средней кинетической энергии поступательного движения молекул идеального газа и формула (4) раскрывает молекулярно-кинетическое толкование температуры.
